题目内容
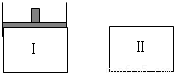
已知Ⅰ容器恒压,Ⅱ容器恒容,其它条件相同时,在Ⅰ、Ⅱ中分别加入3molZ,起始时容积相同,发生反应2X(g)+2Y(s)?3Z(g)并达平衡.下列说法正确的是( )

| A.从起始到平衡所需时间:Ⅰ>Ⅱ |
| B.平衡时Z的转化率:Ⅰ<Ⅱ |
| C.平衡后若在Ⅰ中再加入0.1molY,则X的物质的量将减少 |
| D.平衡后若在Ⅱ中再加入2molZ,则新平衡时Z的体积分数变小 |

在Ⅰ、Ⅱ中分别加入3molZ,起始时容积相同,发生反应3Z(g)?2X(g)+2Y(s)并达平衡.
A、该反应正反应是气体物质的量减小的反应,I是恒压密闭容器,II是恒容密闭容器,反应Ⅰ压强大于反应Ⅱ压强,压强增大,反应速率加快,则从起始到平衡所需时间:I<II,故A错误;
B、反应Ⅰ压强大于反应Ⅱ压强,压强增大平衡向正反应移动,则平衡时Z的转化率:Ⅰ>Ⅱ,故B错误;
C、Y为固体,增大Y的量,不影响平衡移动,则X的物质的量不变,故C错误;
D、平衡后若在Ⅱ中再加入2molZ,相当于在原来基础上缩小体积,压强增大,则平衡正向移动,则新平衡时Z的体积分数变小,故D正确.
故选D.
A、该反应正反应是气体物质的量减小的反应,I是恒压密闭容器,II是恒容密闭容器,反应Ⅰ压强大于反应Ⅱ压强,压强增大,反应速率加快,则从起始到平衡所需时间:I<II,故A错误;
B、反应Ⅰ压强大于反应Ⅱ压强,压强增大平衡向正反应移动,则平衡时Z的转化率:Ⅰ>Ⅱ,故B错误;
C、Y为固体,增大Y的量,不影响平衡移动,则X的物质的量不变,故C错误;
D、平衡后若在Ⅱ中再加入2molZ,相当于在原来基础上缩小体积,压强增大,则平衡正向移动,则新平衡时Z的体积分数变小,故D正确.
故选D.

练习册系列答案
相关题目
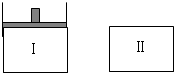 已知Ⅰ容器恒压,Ⅱ容器恒容,其它条件相同时,在Ⅰ、Ⅱ中分别加入3molZ,起始时容积相同,发生反应2X(g)+2Y(s)?3Z(g)并达平衡.下列说法正确的是( )
已知Ⅰ容器恒压,Ⅱ容器恒容,其它条件相同时,在Ⅰ、Ⅱ中分别加入3molZ,起始时容积相同,发生反应2X(g)+2Y(s)?3Z(g)并达平衡.下列说法正确的是( )