题目内容
【题目】已知强酸与强碱在稀溶液里反应的中和热可表示为:H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ·mol-1对下列反应:
CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l) ΔH=-Q1kJ·mol-1
![]() H2SO4(浓)+NaOH(aq)=
H2SO4(浓)+NaOH(aq)=![]() Na2SO4(aq)+H2O(l) ΔH=-Q2kJ·mol-1
Na2SO4(aq)+H2O(l) ΔH=-Q2kJ·mol-1
HNO3(aq)+NaOH(aq)=NaNO3(aq)+H2O(l) ΔH=-Q3kJ·mol-1
上述反应均在溶液中进行,则下列Q1、Q2、Q3的关系正确的是( )
A.Q2>Q3>Q1B.Q2>Q1>Q3C.Q1=Q2=Q3D.Q2=Q3>Q1
【答案】A
【解析】
强酸与强碱的稀溶液发生中和反应的热效应:H+(aq)+OH-(aq)=H2O△H=一57.3kJ/mol;则热化学方程式HNO3(aq)+NaOH(aq)═NaNO3(aq)+H2O(l)△H=-Q3kJmol-1 中的Q3=57.3kJ;而由于醋酸是弱电解质,电离吸热,故热化学方程式CH3COOH(aq)+NaOH(aq)═CH3COONa(aq)+H2O(l)△H=-Q1 kJmol-1 中的Q1<57.3KJ;而浓硫酸稀释放热,故热化学方程式![]() H2SO4(浓)+NaOH(aq)═
H2SO4(浓)+NaOH(aq)═![]() Na2SO4(aq)+H2O(l)△H=-Q2kJmol-1 中的Q2>57.3KJ,故放出的热量为Q2>Q3>Q1,故答案为A。
Na2SO4(aq)+H2O(l)△H=-Q2kJmol-1 中的Q2>57.3KJ,故放出的热量为Q2>Q3>Q1,故答案为A。

 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案【题目】NH3及其盐都是重要的化工原料。
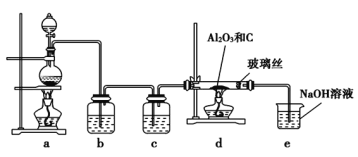
(1)用NH4Cl和Ca(OH)2制备NH3,反应发生、气体收集和尾气处理装置依次为_____。
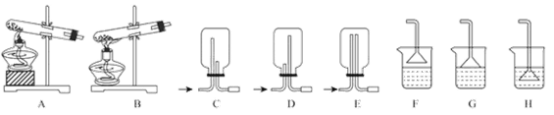
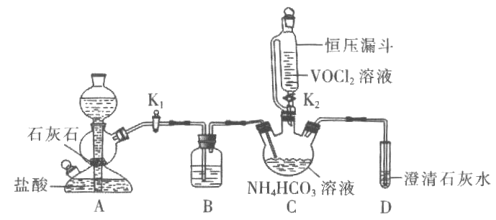
(2)按下图装置进行NH3性质实验。
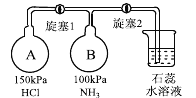
①先打开旋塞1,B瓶中的现象是_______,原因是__________,稳定后,关闭旋塞1。
②再打开旋塞2,B瓶中的现象是_________________。
(3)设计实验,探究某一种因素对溶液中NH4Cl水解程度的影响。
限制试剂与仪器:固体NH4Cl、蒸馏水、100mL容量瓶、烧杯、胶头滴管、玻璃棒、药匙、天平、pH计、温度计、恒温水浴槽(可控制温度)
①实验目的:探究______对溶液中NH4Cl水解程度的影响。
②设计实验方案,拟定实验表格,完整体现实验方案(列出能直接读取数据的相关物理量及需拟定的数据,数据用字母表示;表中V(溶液)表示所配制溶液的体积)。_________________
物理量 | V(溶液)/mL | …… | |||
1 | 100 | ||||
2 | 100 |
③按实验序号I所拟数据进行实验,若读取的待测物理量的数值为Y,则NH4Cl水解反应得平衡转化率
为_____(只列出算式,忽略水自身电离的影响)。