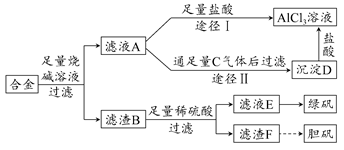
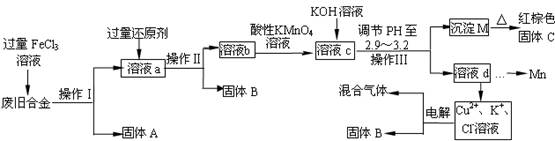
题目内容
下列叙述正确的是______________。
①SO2、NO、NO2都是形成酸雨的因素,都能和水反应生成酸
②除去CO2中少量的SO2,将混合气体通过饱和Na2CO3溶液
③水晶的主要成分是SiO2
④SiO2与CO2都属于酸性氧化物,都不能与酸反应
⑤将CO2通入饱和Na2CO3溶液中有沉淀产生,继续通入CO2沉淀溶解
⑥某酸雨样本采集后放置一段时间,pH由4.68变为4.28,是因为水中溶解了较多的CO2
⑦CO2不能与CaCl2溶液反应,SO2也不能与CaCl2溶液反应
⑧实验室可用NaOH溶液处理NO2和SO2废气
⑨用稀双氧水清洗伤口可以杀菌消毒
⑩NO只能用排水集气法收集,不能用排空气法收集;而NO2只能用排空气法收集,不能用排水集气法
③⑦⑧⑨⑩
解析试题分析:①NO不能与水反应,错误;②CO2也与Na2CO3溶液反应,应该用饱和碳酸氢钠溶液,错误;④SiO2与氢氟酸反应,错误;⑤生成NaHCO3沉淀,NaHCO3不能继续与CO2反应,错误;⑥是因为弱酸H2SO3被氧化为强酸H2SO4,错误;⑨双氧水具有强氧化性,可以使蛋白质发生变性,正确;⑩NO与氧气反应、NO2与水反应,正确。
考点:本题考查物质的成分、性质和用途。

 阅读快车系列答案
阅读快车系列答案下列叙述正确的是
| A.硅是一种重要的非金属单质,可用于制造太阳能电池 |
| B.硫在足量的空气中燃烧生成SO3 |
| C.钠在空气中燃烧生成氧化钠 |
| D.与同浓度稀盐酸反应的速率:Na2CO3>NaHCO3 |
短周期的五种元素A、B、C、D、E,原子序数依次增大。A、B、C三种元素电子层数之和是5。A、B两元素原子最外层电子数之和等于C元素原子最外层电子数;B元素原子最外电子层上的电子数是它的电子层数的2倍,A与D可以形成原子个数比分别为1∶1和2∶1的两种液态化合物;E单质用于净化水质。
请回答:
(1)写出D在元素周期表中的位置 ,
E的原子结构示意图是 。
下列可以验证C与D两元素原子得电子能力强弱的实验事实是 (填写编号)。
A.比较这两种元素的气态氢化物的沸点
B.比较只有这两种元素所形成的化合物中的化合价
C.比较这两种元素的气态氢化物的稳定性
D.比较这两种元素的单质与氢气化合的难易
(2)由A、B两种元素组成的最简单的化合物,写出其电子式 。
(3)均由A、B、C、D四种元素组成的甲、乙两种化合物,都既可以与盐酸反应又可以与NaOH溶液反应,甲为无机盐,其化学式为 ,乙为天然高分子化合物的水解产物,且是同类物质中相对分子质量最小的,其结构简式为 。
(4)胶态磁流体在医学上有重要的用途,而纳米级Fe3O4是磁流体中的重要粒子,其制备过程可简单表示如下:
①将化合物CA3通入等物质的量的FeSO4、Fe2(SO4)3的混合溶液中,生成两种碱,写出该反应过程的总的离子方程式 。
②上述反应生成的两种碱继续作用,得到Fe3O4。
(5)已知下表数据:
| 物质 | Fe(OH)2 | Fe(OH)3 |
| Ksp/25 ℃ | 2.0×10-16 | 4.0×10-36 |
若使混合液中FeSO4、Fe2(SO4)3的浓度均为2.0 mol·L-1,则混合液中c(OH-)不得大于 mol·L-1。
X、Y、Z、W是元素周期表前四周期的常见元素,其相关信息如下表:
| X | X的一种核素的质子数为56,中子数为30 |
| Y | 海水中元素含量最高的金属元素 |
| Z | 常温常压下,Z单质是淡黄色固体,常在火山口附近沉积 |
| W | 价电子的排布式为3s23p3 |
(1)Z元素在元素周期表中的位置为 ,Z的电负性比W的 (填“大”或“小”)。
(2)X元索的基态原子电子排布式是 _ ,其有___种运动状态不同的电子。该元素的白色氧氧化物在空气中会迅速变成灰绿色。最后变成红褐色、其反应的化学方程式为 。
(3)Y的单质在工业上用途广泛,工业上以YW制取Y单质的化学方程式为 。
(4)设计实验验证Z和W的非金属性的强弱: 。
几种短周期元素的原子半径和主要化合价见下表,下列说法中正确的是( )。
| 元素代号 | 原子半径/nm | 主要化合价 |
| X | 0.160 | +2 |
| Y | 0.143 | +3 |
| Z | 0.102 | +6、-2 |
| L | 0.099 | +7、-1 |
| M | 0.077 | +4、-4 |
| Q | 0.074 | -2 |
B.Y与Q形成的化合物不能跟氢氧化钠溶液反应
C.Z的氢化物的稳定性强于L的氢化物的稳定性
D.在化学反应中,M原子与其他原子易形成共价键而不易形成离子键