题目内容
9.NA代表阿伏加德罗常数,下列有关叙述错误的是( )| A. | 56g铁粉在1mol氯气中充分燃烧,失去的电子数为3NA | |
| B. | 标准状况下22.4升CH4和C2H4的混合气体所含氢原子数为4NA28bNA | |
| C. | 常温常压下,3.4gNH3中含N-H键数目为0.6NA | |
| D. | CO2通过足量Na2O2使固体增重bg时,反应中转移的电子数为$\frac{b{N}_{A}}{2}$ |
分析 A.56g铁的物质的量为1mol,1mol铁完全反应消耗3mol氯气,氯气不足,转移的电子按照氨气的量计算;
B.甲烷和乙烯分子中都含有4个H,标况下22.4L混合气体的物质的量为1mol,含有4molH原子;
C.氨气分子中含有3个氮氢键,3.4g氨气的物质的量为0.2mol,含有0.6mol氮氢键;
D.二氧化碳与过氧化钠的反应中,固体增重部分相当于CO的质量,计算出消耗过氧化钠的物质的量,然后得出转移电子数.
解答 解:A.56g铁的物质的量为:$\frac{56g}{56g/mol}$=1mol,1mol铁完全反应需要消耗3mol氯气,显然氯气不足,1mol氯气完全反应得到2mol电子,根据电子守恒铁反应失去的电子数为2NA,故A错误;
B.准状况下22.4升CH4和C2H4的混合气体的物质的量为1mol,1mol混合气体中含有4molH原子,所含氢原子数为4NA,故B正确;
C.3.4g氨气的物质的量为:$\frac{3.4g}{17g/mol}$=0.2mol,0.2mol氨气分子中含有0.6mol氮氢键,含N-H键数目为0.6NA,故C正确;
D.CO2通过Na2O2使其增重bg,增重部分相当于CO的质量,反应中二氧化碳物质的量等于一氧化碳物质的量=$\frac{bg}{28g/mol}$,根据化学方程式2CO2+2Na2O2=2Na2CO3+O2反应消耗过氧化钠物质的量为$\frac{b}{28}$mol,每1mol过氧化钠反应转移电子物质的量为1mol,所以反应中转移电子数为$\frac{b}{28}$NA,故D错误;
故选AD.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意熟练掌握以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系;A为易错点,注意判断反应物的过量情况.

| A. | Na2O、Na2O2组成元素相同,与CO2反应产物也相同 | |
| B. | 、SiO2是酸性氧化物,能与NaOH溶液反应 | |
| C. | 、NO、NO2都是大气污染气体,在空气中都能稳定存在 | |
| D. | .除去石英中的少量碳酸钙,用稀硫酸溶解后过滤分离 |
| A. | Cu与浓硝酸反应生成NO2而与稀硝酸反应生成NO,说明浓度不同氧化性不同 | |
| B. | 在蔗糖中加入浓硫酸后出现黑色物质,说明浓硫酸具有脱水性 | |
| C. | 浓硝酸保存在棕色试剂瓶中,说明浓硝酸不稳定 | |
| D. | 常温下,浓硝酸可以用铝罐贮存,说明铝与浓硝酸不反应 |
| 实验项目 | 实验现象 |
| FeCl3溶液中加入维生素C(Vc) | 溶液褪色为浅绿色 |
| Fe(OH)3胶体通直流电 | 阴极附近红褐色加深 |
| 将铜锈放入盐酸中 | 有无色气泡产生 |
| A. | 维生素C(Vc)具有还原性 | B. | Fe(OH)3胶体粒子带正电荷 | ||
| C. | 铜锈与盐酸反应有H2生成 | D. | 铜锈中含有碳酸根 |
| A. | 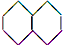 (2组) | B. | 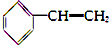 (5组) | C. | 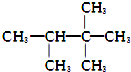 (3组) (3组) | D. | 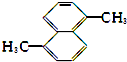 (4组) (4组) |
| A. | pH=1的溶液中:K+、Cr2O72-、CH3CH2OH、SO42- | |
| B. | 加入Al能放出H2的溶液中:K+、NH4+、NO3-、Cl- | |
| C. | 含有大量Fe3+的溶液中:Al3+、Cu2+、Cl-、SO42- | |
| D. | 含有较多Al3+的溶液:HCO3-、K+、Na+、Cl- |
 实验室制硝基苯的装置见如图
实验室制硝基苯的装置见如图 .
.