题目内容
在一定体积pH=12的Ba(OH)2溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的Ba2+恰好完全沉淀时,溶液pH=11。若反应后溶液的体积等于Ba(OH)2溶液与NaHSO4溶液的体积之和,则Ba(OH)2溶液与NaHSO4溶液的体积比是( )A.1∶9 B.1∶1 C.1∶2 D.1∶4
D
解析:pH=12的Ba(OH)2溶液中,c[Ba(OH)2]=![]() ×10-2 mol·L-1。由化学方程式Ba(OH)2+NaHSO4====BaSO4↓+NaOH+H2O可知,当Ba2+恰好完全沉淀时,n[Ba(OH)2]=n(NaHSO4),溶液中n(NaOH)=n[Ba(OH)2]。设Ba(OH)2溶液和NaHSO4溶液的体积分别为V1和V2,由c(OH-)与pH之间的换算公式可知:
×10-2 mol·L-1。由化学方程式Ba(OH)2+NaHSO4====BaSO4↓+NaOH+H2O可知,当Ba2+恰好完全沉淀时,n[Ba(OH)2]=n(NaHSO4),溶液中n(NaOH)=n[Ba(OH)2]。设Ba(OH)2溶液和NaHSO4溶液的体积分别为V1和V2,由c(OH-)与pH之间的换算公式可知:

解得V1∶V2=1∶4。

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
 溶液中,逐滴加入一定物质的量浓度的
溶液中,逐滴加入一定物质的量浓度的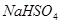 溶液,当溶液中的
溶液,当溶液中的 恰好完全沉淀时,溶液
恰好完全沉淀时,溶液 。若反应后溶液的体积等于
。若反应后溶液的体积等于