题目内容
某研究小组利用工业生产钛白粉产生的废液(含有大量的Fe2+、H+、S和少量的Fe3+、TiO2+)生产乳酸亚铁,其工艺流程如图所示:

(1)反应Ⅰ中,铁屑与TiO2+反应的离子方程式为2TiO2++Fe+4H+?2Ti3++Fe2++2H2O,该反应的平衡常数表达式为K=______.
(2)反应Ⅱ需控制反应温度低于35℃,其目的是______,该反应的化学方程式是______.检验溶液A中是否含Fe2+的实验操作方法是______.
(3)已知:FeCO3(s)?Fe2+(aq)+C(aq),试用平衡移动原理解释反应Ⅲ中生成乳酸亚铁的原因:______.
(4)结晶过程必须控制在一定的真空度条件下进行,原因是:______、______.
解:(1)根据化学平衡常数表达式,可以写出该反应的平衡常数表达式为:K=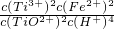 ,故答案为:
,故答案为: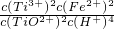 ;
;
(2)反应Ⅱ需控制反应温度低于35℃,其目的是防止NH4HCO3分解(或减少Fe2+的水解);该反应中,反应物是硫酸亚铁和碳酸氢铵,生成物是碳酸铁、二氧化碳,配平方程式为:FeSO4+2NH4HCO3═FeCO3↓+H2O+CO2↑+(NH4)2SO4;检验亚铁离子的方法是:取少量溶液A于试管中,滴入KSCN溶液,无明显现象,再滴入氯水,溶液呈血红色,证明有Fe2+;反之,不含有Fe2+
故答案为:防止NH4HCO3分解(或减少Fe2+的水解);FeSO4+2NH4HCO3═FeCO3↓+H2O+CO2↑+(NH4)2SO4;取少量溶液A于试管中,滴入KSCN溶液,无明显现象,再滴入氯水,溶液呈血红色,证明有Fe2+;反之,不含有Fe2+;
(3)根据平衡移动原理,C与乳酸反应,其浓度降低,使平衡向右移动,碳酸亚铁溶解得到乳酸亚铁;
故答案为:C与乳酸反应,其浓度降低,使平衡向右移动,碳酸亚铁溶解得到乳酸亚铁;
(4)由于在真空度条件下,可以防止亚铁离子氧化,有利于水分的蒸发,故答案为:有利于水的蒸发 防止Fe2+被氧化.
分析:(1)反应物铁和生成物水在反应平衡常数中不写,该反应的平衡常数表达式是K=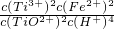 ;
;
(2)碳酸氢铵热稳定性差,反应温度不宜太高;碳酸氢铵和硫酸亚铁反应生成了碳酸铁、二氧化碳和水;亚铁离子的检验方法;
(3)根据勒夏特列原理解释,乳酸和C反应,平衡向着使C增加的方向移动,即正向移动;
(4)结晶过程必须控制在一定的真空度条件下进行,有利于水的蒸发,且防止Fe2+被氧化.
点评:本题考查了乳酸亚铁晶体的制取,涉及了化学平衡常数书写、化学平衡原理的应用等知识,关键是认真分析题中信息,根据所学知识合理处理,本题难度稍大.
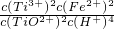 ,故答案为:
,故答案为: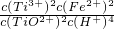 ;
;(2)反应Ⅱ需控制反应温度低于35℃,其目的是防止NH4HCO3分解(或减少Fe2+的水解);该反应中,反应物是硫酸亚铁和碳酸氢铵,生成物是碳酸铁、二氧化碳,配平方程式为:FeSO4+2NH4HCO3═FeCO3↓+H2O+CO2↑+(NH4)2SO4;检验亚铁离子的方法是:取少量溶液A于试管中,滴入KSCN溶液,无明显现象,再滴入氯水,溶液呈血红色,证明有Fe2+;反之,不含有Fe2+
故答案为:防止NH4HCO3分解(或减少Fe2+的水解);FeSO4+2NH4HCO3═FeCO3↓+H2O+CO2↑+(NH4)2SO4;取少量溶液A于试管中,滴入KSCN溶液,无明显现象,再滴入氯水,溶液呈血红色,证明有Fe2+;反之,不含有Fe2+;
(3)根据平衡移动原理,C与乳酸反应,其浓度降低,使平衡向右移动,碳酸亚铁溶解得到乳酸亚铁;
故答案为:C与乳酸反应,其浓度降低,使平衡向右移动,碳酸亚铁溶解得到乳酸亚铁;
(4)由于在真空度条件下,可以防止亚铁离子氧化,有利于水分的蒸发,故答案为:有利于水的蒸发 防止Fe2+被氧化.
分析:(1)反应物铁和生成物水在反应平衡常数中不写,该反应的平衡常数表达式是K=
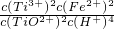 ;
;(2)碳酸氢铵热稳定性差,反应温度不宜太高;碳酸氢铵和硫酸亚铁反应生成了碳酸铁、二氧化碳和水;亚铁离子的检验方法;
(3)根据勒夏特列原理解释,乳酸和C反应,平衡向着使C增加的方向移动,即正向移动;
(4)结晶过程必须控制在一定的真空度条件下进行,有利于水的蒸发,且防止Fe2+被氧化.
点评:本题考查了乳酸亚铁晶体的制取,涉及了化学平衡常数书写、化学平衡原理的应用等知识,关键是认真分析题中信息,根据所学知识合理处理,本题难度稍大.

练习册系列答案
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案
相关题目
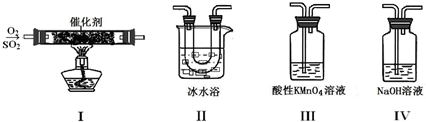
(15分)某校兴趣小组同学欲研究SO2的性质。
(1)将相关的含硫物质分为如下表所示3组,第2组中物质X的化学式是 。
| 第1组 | 第2组 | 第3组 |
| S(单质) | SO2、X、Na2SO3、NaHSO3 | SO3、H2SO4、Na2SO4、NaHSO4 |
(2)利用下图所示的装置研究SO2的性质:
(熔点:SO2 -76.1℃,SO3 16.8℃;沸点:SO3 -10℃,SO3 44.8℃)
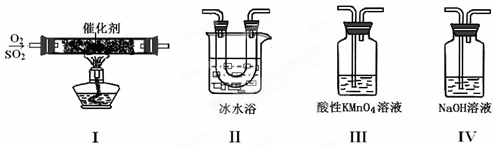
①装置I模拟工业生产中SO2催化氧化的反应,其化学方程式是 。
②甲同学按I、II、III、IV的顺序连接装置,装置II的作用是 ;装置III中溶液逐渐褪色,生成Mn2+,同时pH降低,则该反应的离子方程式是 。
③乙同学按I、II、IV的顺序连接装置,若装置IV中有40 mL 2.5 mol?L-1 NaOH溶液,反应后增重4.8 g,则装置IV中发生反应的总化学方程式是 。
某小组同学欲研究SO2的性质。
(1)将相关的含硫物质分为如下表所示3组,第2组中物质X的化学式是 。
| 第1组 | 第2组 | 第3组 |
| S(单质) | SO2、X、Na2SO3、NaHSO3 | SO3、H2SO4、Na2SO4、NaHSO4 |
(熔点:SO2 -76.1℃,SO3 16.8℃;沸点:SO2 -10℃,SO3 45℃)

①装置Ⅰ模拟工业生产中SO2催化氧化的反应,其化学方程式是 。
②甲同学按Ⅰ、Ⅱ、Ⅲ、Ⅳ的顺序连接装置,装置Ⅱ的作用是 ;装置Ⅲ中溶液逐渐褪色,生成Mn2+,同时pH降低,则该反应的离子方程式是 。
③乙同学按Ⅰ、Ⅱ、Ⅳ的顺序连接装置,若装置Ⅳ中有40 mL 2.5mol/L NaOH溶液,反应后增重4.8 g,则装置Ⅳ中发生反应的化学方程式是 。
某小组同学欲研究SO2的性质。
(1)将相关的含硫物质分为如下表所示的3组,第2组中物质X的化学式是 。
| 第1组 | 第2组 | 第3组 |
| S(单质) | SO2、X、Na2SO3、NaHSO3 | SO3、H2SO4、Na2SO4、NaHSO4 |
(熔点:SO2-76.1℃,SO3 16.8℃;沸点:SO2-10℃,SO3 45℃)
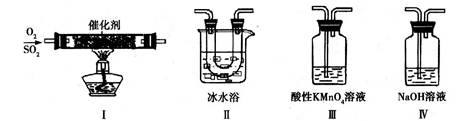
①装置Ⅰ模拟工业生产中SO2催化氧化的反应,其化学方程式是 。
②甲同学按Ⅰ、Ⅱ、Ⅲ、Ⅳ的顺序连接装置,装置Ⅱ的作用是 ;
装置Ⅲ中溶液逐渐褪色,生成Mn2+,同时pH降低,则该反应的离子方程式是
。
③乙同学按Ⅰ、Ⅱ、Ⅳ的顺序连接装置,若装置Ⅳ中有70mL 2mol·L-1NaOH溶液,反应后增重5.12g,则装置Ⅳ中发生反应的化学方程式是 。
某小组同学欲研究SO2的性质。
(1)将相关的含硫物质分为如下表所示的3组,第2组中物质X的化学式是 。
|
第1组 |
第2组 |
第3组 |
|
S(单质) |
SO2、X、Na2SO3、NaHSO3 |
SO3、H2SO4、Na2SO4、NaHSO4 |
(2)利用下图所示的装置研究SO2的性质:
(熔点:SO2-76.1℃,SO3 16.8℃;沸点:SO2-10℃,SO3 45℃)
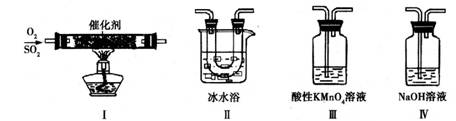
①装置Ⅰ模拟工业生产中SO2催化氧化的反应,其化学方程式是 。
②甲同学按Ⅰ、Ⅱ、Ⅲ、Ⅳ的顺序连接装置,装置Ⅱ的作用是 ;
装置Ⅲ中溶液逐渐褪色,生成Mn2+,同时pH降低,则该反应的离子方程式是
。
③乙同学按Ⅰ、Ⅱ、Ⅳ的顺序连接装置,若装置Ⅳ中有70mL 2mol·L-1NaOH溶液,反应后增重5.12g,则装置Ⅳ中发生反应的化学方程式是 。