��Ŀ����
����Ŀ�������£���0.1molL��1NaOH��Һ�ֱ�ζ������Ϊ20mlŨ�Ⱦ�Ϊ0.1molL��1HCl��Һ��HX��Һ����Һ��pH�����NaOH��Һ����仯ͼ������˵������ȷ���ǣ� �� 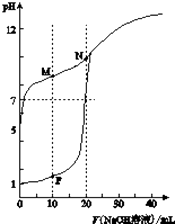
A.HX����
B.M��c��HX����c��X������c��OH������c��H+��
C.��P���N�����ҺΪ��ϣ�������
D.��N����Һ��ͨ��HCl��pH=7��c��Na+����c��HX��=c��Cl������c��X����
���𰸡�C
���������⣺A��δ�ζ�ʱ��0.1molL��1HCl��ҺpHΪ1����ͼ��֪0.1mol/L HX��Һ��pH��5����HX���ᣬ��A��ȷ��
B��M��Ϊ��Ũ��NaX��HX�����Һ������Һ�ʼ��ԣ�˵��X����ˮ��̶ȴ���HX�ĵ���̶ȣ��������غ��֪��2c��Na+��=c��X����+c��HX������ϵ���غ�c��Na+��+c��H+��=c��X����+c��OH�����������ɵã�c��X����+c��HX��+2c��H+��=2c��X����+2c��OH�����������ã�c��HX����c��X����=2c��OH������2c��H+����c��OH������c��H+������B��ȷ��
C��P����Һ��NaCl��HCl���ʵ�����ȣ�N��ΪNaX��Һ��NaX���ʵ���ΪHCl��2������Ϻ�ΪNaCl��NaX��HX�����Һ������Һ��NaX��HX��Ũ����ȣ�����X����ˮ��̶ȴ���HX�ĵ���̶ȣ��ʼ��ԣ���C����
D�����ݵ���غ㣺c��Na+��+c��H+��=c��Cl����+c��X����+c��OH��������ҺpH=7����c��Na+��=c��Cl����+c��X�������������غ��֪c��Na+��=c��X����+c��HX���������ɵ�c��HX��=c��Cl����������ҺΪNaCl��NaX��HX�Ļ����Һ����ͬŨ����X����ˮ��̶ȴ���HX�ĵ���̶ȣ�������ҺΪ���ԣ�����Һ��c��NaX����c��HX��������Һ��c��Na+����c��HX��=c��Cl������c��X��������D��ȷ��
��ѡ��C��



