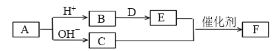
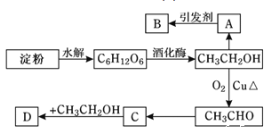
题目内容
【题目】已知![]() 可简写为
可简写为![]() 。现有某化合物W的分子结构可表示为:
。现有某化合物W的分子结构可表示为:![]() 。
。
(1)W的分子式为___________;
(2)W的一氯代物有______种。
(3)下列有关W的说法不正确的是_______(填编号)。
a. 能发生还原反应 b. 能发生氧化反应 c. 能发生加聚反应
d. 等质量的W与苯分别完全燃烧所消耗的氧气量,前者大
(4)写出W的芳香族同分异构体(能发生聚合反应)的结构简式________,该聚合反应的化学方程式为__________________________________________________。
(5)W属于_____(填编号)。
a. 芳香烃 b. 环烃 c. 不饱和烃 d. 炔烃
【答案】C8H8 2 d 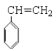
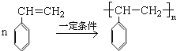 bc
bc
【解析】
(1)根据W的结构简式书写分子式;
(2) ![]() 有2种等效氢;
有2种等效氢;
(3)根据W分子中含有碳碳双键分析性质;
(4) W的芳香族同分异构体(能发生聚合反应)的是苯乙烯;
(5)根据![]() 的结构分析;
的结构分析;
(1) W的结构简式是![]() ,
,![]() 的分子式是C8H8;
的分子式是C8H8;
(2) ![]() 有2种等效氢,
有2种等效氢,![]() 的一氯代物有2种;
的一氯代物有2种;
(3) ![]() 分子中含有碳碳双键, 能与氢气加成,发生还原反应;含有碳碳双键,能发生氧化反应;含有碳碳双键,能发生加聚反应;
分子中含有碳碳双键, 能与氢气加成,发生还原反应;含有碳碳双键,能发生氧化反应;含有碳碳双键,能发生加聚反应; ![]() 与苯中碳元素质量分数相同,所以等质量的W与苯分别完全燃烧所消耗的氧气量相等;不正确的是d。
与苯中碳元素质量分数相同,所以等质量的W与苯分别完全燃烧所消耗的氧气量相等;不正确的是d。
(4) W的芳香族同分异构体(能发生聚合反应)的是苯乙烯,结构简式是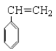 ;
; 一定条件下聚合为聚苯乙烯,反应的化学方程式为
一定条件下聚合为聚苯乙烯,反应的化学方程式为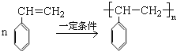 ;
;
(5) a. ![]() 不含苯环,不属于芳香烃,a错误;
不含苯环,不属于芳香烃,a错误;
b. ![]() 含有环状结构,属于环烃,b正确;
含有环状结构,属于环烃,b正确;
c. 含有碳碳双键,属于不饱和烃,c正确;
d. 不含碳碳叁键,不属于炔烃,d错误;
故合理选项为bc。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业。实验室利用下图A装置制备乙酸乙酯。

(1)若实验中用乙酸和含18O的乙醇作用,该反应的化学方程式是:______.与教材采用的实验装置不同,此装置中采用了球形干燥管,其作用是______.
(2)为了证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用上图所示装置进行了以下4个实验.实验开始先用酒精灯微热3min,再加热使之微微沸腾3min.实验结束后充分振荡小试管Ⅱ再测有机层的厚度,实验记录如下:
实验编号 | 试管I中的试剂 | 试管II中的试剂 | 有机层的厚度/cm |
A | 2mL乙醇、1mL乙酸 1mL18molL-1浓硫酸 | 饱和Na2CO3 | 3.0 |
B | 2mL乙醇、1mL乙酸 | 0.1 | |
C | 2mL乙醇、1mL乙酸 3mL2molL-1H2SO4 | 0.6 | |
D | 2mL乙醇、1mL乙酸、盐酸 | 0.6 |
①实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用.实验D中应加入盐酸的体积和浓度分别是______mL和______molL-1。
②分析实验______(填实验编号)的数据,可以推测出浓H2SO4的吸水性提高了乙酸乙酯的产率。
(3)若现有乙酸90g,乙醇138g发生酯化反应得到88g乙酸乙酯,试计算该反应的产率为______。
(4)为充分利用反应物,甲、乙两位同学分别设计了如图甲、乙两个装置(乙同学待反应完毕冷却后,再用饱和碳酸钠溶液提取烧瓶中的产物).你认为最合理的是______。
【题目】在三个体积均为2 L恒容密闭容器中,反应CO(g)+2H2(g)![]() CH3OH(g) ΔH<0达到平衡,得到如下数据。下列说法正确的是
CH3OH(g) ΔH<0达到平衡,得到如下数据。下列说法正确的是
容器编号 | 温度/K | 物质的起始物质的量/mol | 物质的平衡物质的量/mol | ||
CO(g) | H2(g) | CH3OH(g) | CH3OH(g) | ||
Ⅰ | T1 | 0.40 | 0.80 | 0 | 0.24 |
Ⅱ | T2 | 0 | 0 | 0.40 | 0.20 |
Ⅲ | T2 | a | b | ||
A.反应温度:T1<T2
B.达平衡时,转化率:α(CO,Ⅰ)+α(CH3OH,Ⅱ)>1
C.在容器Ⅲ中,若平衡时,CO的转化率大于H2,则![]()
D.在容器Ⅲ中,若起始时加入0.4 mol CO、0.4 mol H2和0.4 mol CH3OH,则此时v(正)>v(逆)