题目内容
室温下将等物质的量的NaCN和HCN溶于一定量水中,再加入适量稀盐酸,调整溶液pH=7。下列说法正确的是( )
A.未加入稀盐酸之前:c(HCN)>c(Na+)>c( CN-) >c(OH-)>c(H+)
B.加稀盐酸后溶液中c(CN-)+c(HCN)= c(Na+)
C.pH=7时,溶液中:c( Na+)= c( CN-)
D.加稀盐酸后H2O的电离程度减小
【答案】
AD
【解析】
试题分析:等物质的量的NaCN和HCN溶于一定量水中形成的溶液加入盐酸后,溶液呈中性,说明加盐酸之前呈碱性,则说明水解大于电离,所以A项c(HCN)>c(Na+)>c( CN-) >c(OH-)>c(H+)正确;根据物料守恒,加盐酸前后c(CN-)+c(HCN)= 2c(Na+),所以B错误;加盐酸后有电荷守恒c(Na+)+c(H+)=c( CN-) +c(OH-)+ c( Cl-),又c(H+)=c(OH-),所以c(Na+)=c( CN-)+c( Cl-),C错误;由于加盐酸之前是水解呈碱性促进水电离,加酸后呈中性,所以使水的电离程度减小,D正确;故选AD。
考点:本题考查的是溶液中离子浓度的大小比较。

练习册系列答案
 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案
相关题目
硫酸亚铁可与等物质的量的硫酸铵生成硫酸亚铁铵:(NH4)2SO4?FeSO4?6H2O,商品名称为莫尔盐,是一种复盐.一般亚铁盐在空气中易被氧气氧化,形成复盐后就比较稳定.与其他复盐一样,硫酸亚铁铵在水中的溶解度比组成它的每一种盐的溶解度都小,且几乎不溶于乙醇,利用这一性质可以制取硫酸亚铁铵晶体.三种盐的溶解度(单位为g/l00gH2O)见下表:
实验用品:Fe屑(含少量碳)、3mol/LH2SO4、( NH4)2SO4、蒸馏水、无水乙醇.
实验步骤流程图:
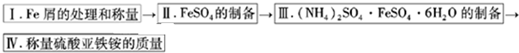
请完成以下实验记录:
(1)步骤I中用10% Na2CO3的热溶液处理铁屑的目的是 ,经处理后的干燥铁屑质量记为m1;
(2)将称量好的Fe屑放入锥形瓶中,加入适量3mol/LH2SO4溶液,放在水浴中加热至气泡量产生较少时为止(有氢气生成,用明火加热注意安全).趁热过滤,并用少量热水洗涤锥形瓶及滤纸,将滤液和洗涤液一起转移至蒸发皿中.将滤纸上的固体常温干燥后称重,记为m2;
(3)称取一定质量的(NH4)2SO4,加入 g(用含m1和m2的代数式表示,要求化简,下同.)水配制成室温下(20℃)的饱和溶液,并将其加入到上面实验的蒸发皿中,缓缓加热,浓缩至表面出现结晶薄膜为止.放置冷却,得到硫酸亚铁铵的晶体,过滤后用 洗涤晶体.
(4)产品纯度的测定
先称取产品1.600g,加水溶解,配成100ml溶液,移取25.00mL待测溶液与锥形瓶中,再用硫酸酸化的0.0100mol/LKMnO4标准溶液进行滴定其中的Fe2+,达到滴定终点时消耗标准液的平均值为20.00mL,则样品中的(NH4)2SO4?FeSO4?6H2O的质量分数?(列式计算)
| 温度/℃ | FeSO4?7H2O | (NH4)2SO4 | (NH4)2SO4?FeSO4?6H2O |
| 10 | 20.0 | 73.0 | 17.2 |
| 20 | 26.5 | 75.4 | 21.6 |
| 30 | 32.9 | 78.0 | 28.1 |
实验步骤流程图:

请完成以下实验记录:
(1)步骤I中用10% Na2CO3的热溶液处理铁屑的目的是
(2)将称量好的Fe屑放入锥形瓶中,加入适量3mol/LH2SO4溶液,放在水浴中加热至气泡量产生较少时为止(有氢气生成,用明火加热注意安全).趁热过滤,并用少量热水洗涤锥形瓶及滤纸,将滤液和洗涤液一起转移至蒸发皿中.将滤纸上的固体常温干燥后称重,记为m2;
(3)称取一定质量的(NH4)2SO4,加入
(4)产品纯度的测定
先称取产品1.600g,加水溶解,配成100ml溶液,移取25.00mL待测溶液与锥形瓶中,再用硫酸酸化的0.0100mol/LKMnO4标准溶液进行滴定其中的Fe2+,达到滴定终点时消耗标准液的平均值为20.00mL,则样品中的(NH4)2SO4?FeSO4?6H2O的质量分数?(列式计算)