题目内容
11.下列框图中的物质均为中学化学中常见物质,其中甲、乙为单质,其余均为化合物.B为常见液态化合物,A为淡黄色固体,F、G所含元素相同且均为氯化物,G遇KSCN溶液显红色.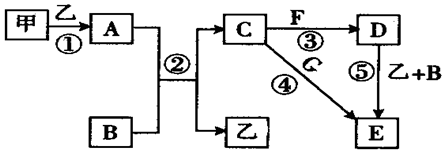
请回答下列问题:
(1)ANa2O2B,H2OC,NaOHD,Fe(OH)2E.Fe(OH)3
(2)反应①~⑤中,属于氧化还原反应的是①②⑤(填序号).
(3)反应⑤的化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3;
甲与B反应的离子方程式为2Na+2H2O=2Na++2OH-+H2↑.
A与B反应的离子方程式为2Na2O2+2H2O=4Na++4OH-+O2↑.
(4)在空气中将C溶液滴入F溶液中,观察到的现象是先生成白色沉淀,然后迅速变为灰绿色,最终变为红褐色.
分析 甲、乙为单质,二者反应生成A为淡黄色固体,则A为Na2O2,甲、乙分别为Na、氧气中的一种;B为常见液态化合物,与A反应生成C与乙,可推知B为H2O、乙为氧气、C为NaOH,则甲为Na;F、G所含元素相同且均为氯化物,G遇KSCN溶液显红色,则G为FeCl3,F为FeCl2,结合转化关系可知,E为Fe(OH)3,D为Fe(OH)2,以此解答该题.
解答 解:(1)由以上分析可知A为Na2O2,B为H2O,C为NaOH,D为Fe(OH)2,E为Fe(OH)3,故答案为:Na2O2;H2O;NaOH;Fe(OH)2;Fe(OH)3;
(2)反应①~⑤中,①②⑤属于氧化还原反应,③④属于非氧化还原反应,故答案为:①②⑤;
(3)反应⑤的化学方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
甲与B反应的离子方程式为:2Na+2H2O=2Na++2OH-+H2↑,
A与B反应的离子方程式为2Na2O2+2H2O=4Na++4OH-+O2↑,
故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;2Na+2H2O=2Na++2OH-+H2↑;2Na2O2+2H2O=4Na++4OH-+O2↑;
(4)在空气中将NaOH溶液滴入FeCl2溶液中,先生成氢氧化亚铁沉淀,再被氧化生成氢氧化铁,观察到的现象是:先生成白色沉淀,然后迅速变为灰绿色,最终变为红褐色,
故答案为:先生成白色沉淀,然后迅速变为灰绿色,最终变为红褐色.
点评 本题考查无机物推断,为高考常见题型,侧重考查学生的分析能力,题目涉及Na、Fe元素化合物的性质及转化,物质的颜色是推断突破口,再结合转化关系推断,需要学生熟练掌握物质的性质,难度中等.

练习册系列答案
相关题目
2.下列有关物质的性质或应用的说法不正确的是( )
| A. | 二氧化硅是光纤制品的基本原料 | |
| B. | 水玻璃可用于生产黏合剂和防火剂 | |
| C. | 硅元素在自然界中既有游离态也有化合态 | |
| D. | 硅是将太阳能转化为电能的常用材料 |
19.下列有关化学与生活、工业的叙述中,不正确的是( )
| A. | 工业上生产玻璃、水泥、漂白粉及用铁矿石冶炼铁,均需要用石灰石为原料 | |
| B. | 高空中臭氧层能够吸收太阳紫外线,为地球上的生物提供了天然的保护屏障,但低空的臭氧浓度过大,会给生物造成伤害 | |
| C. | 2011年5月份起,面粉中禁止添加CaO2、过氧化苯甲酰等增白剂,CaO2属于碱性氧化物,过氧化苯甲酰属于有机物 | |
| D. | 用K2FeO4代替Cl2处理饮用水,有杀菌消毒作用,且不会形成致癌物,还有净水作用 |
6.下列化学用语书写正确的是( )
| A. | 甲基的电子式: | B. | 2-丁烯的键线式: | ||
| C. | 丙烯的结构简式:CH2CHCH3 | D. | 二乙醇的结构式: |
3.下列有关乙醇性质的化学方程式正确的是( )
| A. | 与金属钠反应:2CH3CH2OH+2Na→2CH3CH2ONa+H2↑ | |
| B. | 与氧气的燃烧反应:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O | |
| C. | 与氧气的催化氧化:CH3CH2OH+3O2$\stackrel{点燃}{→}$2CO2+3H2O | |
| D. | 与乙酸的酯化反应:CH3COOH+CH3CH2OH$\frac{\underline{\;浓硫酸\;}}{△}$CH3COOCH2CH3 |
20.NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 标况下,22.4LSO3含氧原子数为3NA | |
| B. | 将1molCl2通入到水中,则N(HClO)+N(Cl-)+N(ClO-)=2NA | |
| C. | 2 molSO2和1 molO2在密闭容器中加热(V2O5催化)充分反应后,容器内分子总数大于2NA | |
| D. | 密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA |
19.设NA表示阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 10mL 5mol/L(NH4)2SO4溶液中含有NH4+数目为0.1NA | |
| B. | 100g质量分数为98%的浓硫酸中所含氧原子数为4NA | |
| C. | 1mol FeCl3完全水解转化为氢氧化铁胶体后能生成NA个胶粒 | |
| D. | 室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA |

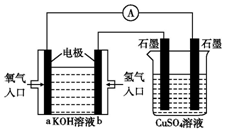 可用碱性氢氧燃料电池组装如图所示的装置:
可用碱性氢氧燃料电池组装如图所示的装置: