题目内容
下列实验操作能够达到实验目的的是

A. 实验室采用图①所示装置收集SO2
B. 可用图②所示装置比较KMnO4、Cl2、S的氧化性强弱
C. 除去NaHCO3溶液中的Na2CO3,可加入Ca(OH)2溶液后过滤
D. 称取0.40 g NaOH,置于100 mL容量瓶中,加水溶解,配制0.10 mol/L NaOH溶液
练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
已知硫酸、氨水的密度与所加水量的关系如图所示,现有硫酸与氨水各一份,请根据表中的信息,回答下列问题 :
溶质的物质的量浓度/ | 溶液的密度/ |
| |
硫酸 |
|
| |
氨水 |
|
|
(1)表中硫酸的质量分数为__________(不写单位,用含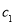 、
、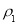 的代数式表示)。
的代数式表示)。
(2)物质的量浓度为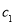
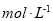 的硫酸与水等体积混合(混合后溶液体积变化忽略不计),所得溶液的物质的量浓度为___________
的硫酸与水等体积混合(混合后溶液体积变化忽略不计),所得溶液的物质的量浓度为___________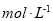 。
。
(3)物质的量浓度为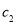
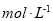 的氨水与
的氨水与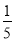
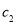
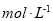 的氨水等质量混合,所得溶液的密度______(填
的氨水等质量混合,所得溶液的密度______(填
“大于”、“小于”或“等于”,下同) 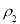
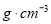 ,所得溶液的物质的量浓度________
,所得溶液的物质的量浓度________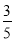
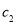
(设混合后溶液的体积变化忽略不计)
(4)若将稀硫酸与氨水混合,写出其反应的离子方程式___________________________.
向四支试管中分别加入少量不同的无色无味溶液进行如下操作,结论正确的是
操作 | 现象 | 结论 | |
A | 先加硝酸,再滴加BaCl2溶液 | 生成白色沉淀 | 原溶液中有SO42- |
B | 先加入H2O2溶液,再加KSCN溶液 | 生成血红色溶液 | 原溶液中有Fe3+原子 |
C | 用洁净铂丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 原溶液中有Na+、无K+ |
D | 滴加稀NaOH溶液,加热,将湿润红色石蕊试纸置于试管口 | 试纸变蓝 | 原溶液中有NH4+ |
3.孔雀石的主要成分为Cu2(OH)2CO3,还含少量Fe、Si的化合物.实验室以孔雀石为原料制备CuCl2•3H2O及CaCO3的步骤如下:

为解决有关问题,兴趣小组同学查得有关物质沉淀的pH数据如下:
(1)“除杂”时先通入足量Cl2将Fe2+氧化成Fe3+,可加入(填化学式)调节溶液的pH至3.2~4.7(填写范围).检验Fe(OH)3是否沉淀完全的实验操作、现象及结论是取少量上层清液,滴加KSCN溶液,若不出现血红色,表明Fe(OH)3沉淀完全
(2)操作X包括蒸发浓缩、冷却结晶、过滤和洗涤等.CuCl2•3H2O加热灼烧的最终产物的化学式是过滤洗涤CuO.

为解决有关问题,兴趣小组同学查得有关物质沉淀的pH数据如下:
| 物质 | pH (开始沉淀) | pH(完全沉淀) |
| Fe(OH)3 | 1.9 | 3.2 |
| Fe(OH)2 | 7.0 | 9.0 |
| Cu(OH)2 | 4.7 | 6.7 |
(2)操作X包括蒸发浓缩、冷却结晶、过滤和洗涤等.CuCl2•3H2O加热灼烧的最终产物的化学式是过滤洗涤CuO.
20.正确表示下列反应的离子方程式的是( )
| A. | 碳酸钙与盐酸反应:CO32-+2H+═CO2↑+H2O | |
| B. | 铁溶于氯化铁溶液:Fe3++Fe═2Fe2+ | |
| C. | 氢氧化钠溶液与硫酸反应:H++OH-═H2O | |
| D. | 钠与水反应:Na+2H2O═Na++2OH-+H2↑ |




 同学的实验设计方案是否严密?请说明理由:________________________________。
同学的实验设计方案是否严密?请说明理由:________________________________。 的KNO3
的KNO3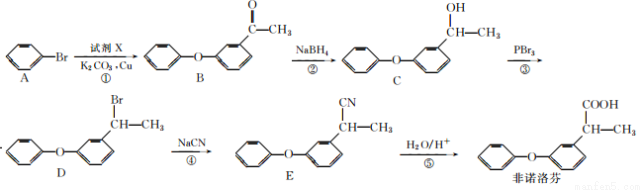
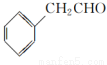 为原料制备
为原料制备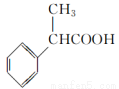 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。