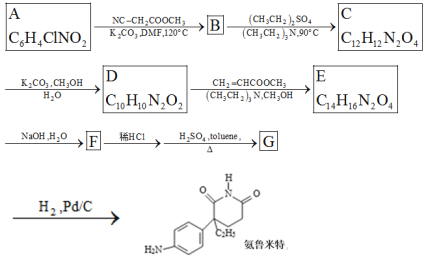
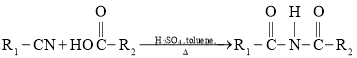
题目内容
【题目】下图是磷酸、亚磷酸、次磷酸的结构式,其中磷酸为三元中强酸,亚磷酸为二元弱酸,则下列说法正确的是( )。
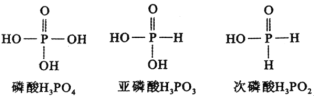
A.磷酸(![]() )的电离方程式为:
)的电离方程式为:![]()
B.亚磷酸(![]() )与足量NaOH溶液反应生成
)与足量NaOH溶液反应生成![]()
C.![]() 溶液呈酸性,是因为
溶液呈酸性,是因为![]() 的水解程度比电离程度大
的水解程度比电离程度大
D.![]() 溶液呈碱性
溶液呈碱性
【答案】D
【解析】
A.磷酸为三元中强酸,应分步电离,且可逆,电离方程式为H3PO4H++H2PO![]() ,H2PO
,H2PO![]() H++HPO
H++HPO![]() ,HPO
,HPO![]() H++PO
H++PO![]() ,故A错误;
,故A错误;
B.亚磷酸为二元弱酸,只能电离出两个氢离子,所以与足量NaOH溶液反应生成Na2HPO3,故B错误;
C.如果![]() 溶液呈酸性,说明
溶液呈酸性,说明![]() 电离程度大于水解程度,故C错误;
电离程度大于水解程度,故C错误;
D.磷酸含有三个羟基氢为三元酸,亚磷酸含有两个羟基氢为二元酸,而次磷酸只含一个羟基氢,所以应为一元酸,所以![]() 为正盐,且为强碱弱酸盐,溶液中存在次磷酸根的水解,使溶液显碱性,故D正确;
为正盐,且为强碱弱酸盐,溶液中存在次磷酸根的水解,使溶液显碱性,故D正确;
故答案为D。

 阅读快车系列答案
阅读快车系列答案【题目】Ⅰ.在![]() 密闭容器中放入
密闭容器中放入![]() ,在一定温度进行如下反应:
,在一定温度进行如下反应:![]()
容器内气体总压强(P)与起始压强![]() 的比值随反应时间(t)数据见下表:(提示,密闭容器中的压强比等于气体物质的量之比)
的比值随反应时间(t)数据见下表:(提示,密闭容器中的压强比等于气体物质的量之比)
时间 | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | |
| 1.00 | 1.50 | 1.80 | 2.20 | 2.30 | 2.38 | 2.40 | 2.40 |
回答下列问题
(1)下列能提高A的转化率的是_______
A.升高温度 B.体系中通入A气体
C.将D的浓度减小 D.通入稀有气体![]() ,使体系压强增大到原的5倍
,使体系压强增大到原的5倍
(2)该反应的平衡常数的表达式K_______,前2小时C的反应速率是_________![]() ;
;
(3)平衡时A的转化率___________,C的体积分数__________(均保留两位有效数字)
(4)相同条件下,若该反应从逆向开始,建立与上述相同的化学平衡,则D的物质的量取值范围![]() ______
______![]()
Ⅱ.已知乙酸是一种重要的化工原料,该反应所用的原理与工业合成乙酸的原理类似;常温下,将![]() 溶于水配成
溶于水配成![]() 溶液,向其中滴加等体积的
溶液,向其中滴加等体积的![]() 的盐酸使溶液呈中性(不考虑醋酸和盐酸的挥发),用含a和b的代数式表示醋酸的电离常数
的盐酸使溶液呈中性(不考虑醋酸和盐酸的挥发),用含a和b的代数式表示醋酸的电离常数![]() ___________
___________