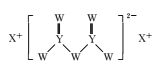
题目内容
【题目】阿司匹林是一种常见药物,它的相对分子质量为180,含C、H、O三种元素,其中含C、H的质量分数分别为60%、4.4%,则阿司匹林的分子式是( )
A.C10H9O4B.C10H22O3C.C9H10O4D.C9H8O4
【答案】D
【解析】
根据有机物的摩尔质量,以及所含各元素的质量分数可计算出每一种元素的物质的量。各元素原子的物质的量之比等于其分子式中的各原子个数的最简比。据此解题。
根据阿司匹林的相对分子质量为180,可知其摩尔质量为180 g·mol-1,因其中含C、H的质量分数分别为60%、4.4%,故氧元素的质量分数为35.6%。因此可计算出C元素的物质的量为:![]() =9mol;H元素的物质的量为:
=9mol;H元素的物质的量为:![]() 8mol;O元素的物质的量为:
8mol;O元素的物质的量为:![]() 4mol,由此可写出阿司匹林的分子式为C9H8O4。答案应选D。
4mol,由此可写出阿司匹林的分子式为C9H8O4。答案应选D。

 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案【题目】已知:乙二酸(HOOC—COOH,可简写为H2C2O4),俗称草酸,157℃时开始分解。
(1)探究草酸的酸性
25℃ H2C2O4 K1=5.4×10-2,K2=5.4×10-5;H2CO3 K1=4.5×10-7,K2=4.7×10-11
下列化学方程式可能正确的是___。
A.H2C2O4+![]() =
=![]() +
+![]() B.
B.![]() +
+![]() =
=![]() +
+![]()
C.2![]() +CO2+H2O=2
+CO2+H2O=2![]() +
+![]() D.H2C2O4+
D.H2C2O4+![]() =
=![]() +H2O+CO2↑
+H2O+CO2↑
(2)探究草酸分解产物
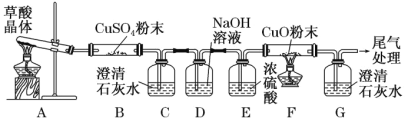
实验中观察到 B 中 CuSO4 粉末变蓝,C 中澄清石灰水变浑浊,D 的作用是 ___, 证明有 CO 气体生成的现象是______。
(3)探究催化剂对化学反应速率的影响
在甲、乙两支试管中各加入 4 mL 0.01 mol·L-1 酸性 KMnO4 溶液和 2 mL 0.1 mol·L-1H2C2O4 溶液,再向乙试管中加入一粒黄豆大的 MnSO4 固体,摇匀。填写表格:
反应现象 | ①_______ |
实验结论 | ②______ |
试管中发生反应的离子方程式 | ③______ |
(4)用酸性 KMnO4 溶液滴定 Na2C2O4,求算 Na2C2O4 的纯度。
实验步骤:准确称取 2.0 g Na2C2O4 固体,配成 100 mL 溶液;取出 20.00 mL 于锥形瓶
①KMnO4 溶液应装在_________ 滴定管中。(填“酸式”或“碱式”)
②Na2C2O4 的纯度是_________。