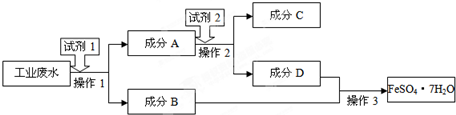
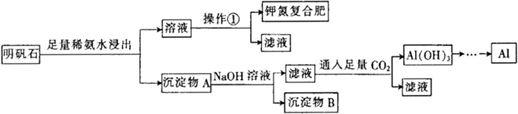
题目内容
某厂废液中含有大量Ag+、Fe3+、Al3+,用下列图示方法进行分离(部分反应条件省略):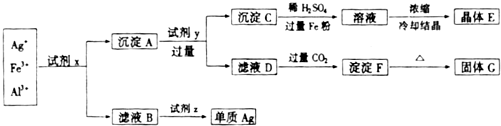
(1)写出下列物质的化学式:试剂x 、试剂z .晶体E 、固体G
(2)写出下列反应的离子方程式:沉淀A+试剂y:
滤液D+过量CO2: .

(1)写出下列物质的化学式:试剂x
(2)写出下列反应的离子方程式:沉淀A+试剂y:
滤液D+过量CO2:
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题,元素及其化合物
分析:向溶液中通入过量氨气,Fe3+、Al3+和NH3.H2O反应都生成氢氧化物沉淀,Ag+和过量NH3.H2O反应生成银氨溶液,则试剂x是氨气或氨水,滤液B是银氨溶液,向B中加入醛反应生成Ag单质甲,所以试剂Z是醛;
向沉淀A中加入NaOH溶液,Al(OH)3溶解,Fe(OH)3不溶,则试剂Y是NaOH,沉淀C为Fe(OH)3,滤液D中含有NaAlO2、NaOH,向D溶液中通入过量CO2,得到沉淀F为Al(OH)3,将沉淀加热得到化合物G为Al2O3;
将Fe(OH)3沉淀C加稀硫酸和过量的铁粉得硫酸亚铁溶液,浓缩冷却结晶得晶体E为硫酸亚铁,再结合问题分析解答.
向沉淀A中加入NaOH溶液,Al(OH)3溶解,Fe(OH)3不溶,则试剂Y是NaOH,沉淀C为Fe(OH)3,滤液D中含有NaAlO2、NaOH,向D溶液中通入过量CO2,得到沉淀F为Al(OH)3,将沉淀加热得到化合物G为Al2O3;
将Fe(OH)3沉淀C加稀硫酸和过量的铁粉得硫酸亚铁溶液,浓缩冷却结晶得晶体E为硫酸亚铁,再结合问题分析解答.
解答:
解:向溶液中通入过量氨气,Fe3+、Al3+和NH3.H2O反应都生成氢氧化物沉淀,Ag+和过量NH3.H2O反应生成银氨溶液,则试剂x是氨气或氨水,滤液B是银氨溶液,向B中加入醛反应生成Ag单质甲,所以试剂Z是醛;
向沉淀A中加入NaOH溶液,Al(OH)3溶解,Fe(OH)3不溶,则试剂Y是NaOH,沉淀C为Fe(OH)3,滤液D中含有NaAlO2、NaOH,向D溶液中通入过量CO2,得到沉淀F为Al(OH)3,将沉淀加热得到化合物G为Al2O3;
将Fe(OH)3沉淀C加稀硫酸和过量的铁粉得硫酸亚铁溶液,浓缩冷却结晶得晶体E为硫酸亚铁,
(1)通过以上分析知,试剂X的名称为氨气或氨水,试剂Z的化学式为NaOH,晶体E为硫酸亚铁,固体G为Al2O3;
故答案为:NH3;NaOH;FeSO4;Al2O3;
(2)通过以上分析知,沉淀A+试剂y的离子方程式为:Al(OH)3+OH-═AlO2-+H2O;滤液D+过量CO2:离子方程式为AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-,故答案为:Al(OH)3+OH-═AlO2-+H2O;AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-.
向沉淀A中加入NaOH溶液,Al(OH)3溶解,Fe(OH)3不溶,则试剂Y是NaOH,沉淀C为Fe(OH)3,滤液D中含有NaAlO2、NaOH,向D溶液中通入过量CO2,得到沉淀F为Al(OH)3,将沉淀加热得到化合物G为Al2O3;
将Fe(OH)3沉淀C加稀硫酸和过量的铁粉得硫酸亚铁溶液,浓缩冷却结晶得晶体E为硫酸亚铁,
(1)通过以上分析知,试剂X的名称为氨气或氨水,试剂Z的化学式为NaOH,晶体E为硫酸亚铁,固体G为Al2O3;
故答案为:NH3;NaOH;FeSO4;Al2O3;
(2)通过以上分析知,沉淀A+试剂y的离子方程式为:Al(OH)3+OH-═AlO2-+H2O;滤液D+过量CO2:离子方程式为AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-,故答案为:Al(OH)3+OH-═AlO2-+H2O;AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-.
点评:本题考查混合物的电离和提纯,侧重考查学生对元素化合物知识的掌握程度及对知识的灵活运用能力,难点是试剂的选取,题目难度中等.

练习册系列答案
相关题目
有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期,Z、M同主族;X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的单质晶体是一种重要的半导体材料.下列说法正确的是( )
| A、X、M两种元素形成的化合物的中一定含有离子键,不可能含有共价键 |
| B、由于W、Z、M元素的氢化物的相对分子质量依次减小,所以其沸点依次降低 |
| C、元素Y、Z、W、M的电负性高低顺序为:M>W>Z>Y |
| D、化合物ZW2的分子空间构型为直线形 |
下列各物质中所有碳原子不在同一平面的是( )
| A、甲苯 | B、丙烯 |
| C、乙烯 | D、1-丁烯 |
 欲测定某NaOH溶液的物质的量浓度,可用0.1000mol?L-1HCl标准溶液进行中和滴定(用甲基橙作指示剂).请回答下列问题:
欲测定某NaOH溶液的物质的量浓度,可用0.1000mol?L-1HCl标准溶液进行中和滴定(用甲基橙作指示剂).请回答下列问题: