��Ŀ����
����Ŀ����һ���ܱ������з������·�Ӧ��2SO2��g����O2��g��![]() 2SO3��g������Ӧ������ijһʱ�̲��SO2��O2��SO3��Ũ�ȷֱ�Ϊ0.2mol��L��1��0.2 mol��L��1��0.2 mol��L��1������Ӧ�ﵽƽ��ʱ�����ܳ��ֵ������ǣ� ��
2SO3��g������Ӧ������ijһʱ�̲��SO2��O2��SO3��Ũ�ȷֱ�Ϊ0.2mol��L��1��0.2 mol��L��1��0.2 mol��L��1������Ӧ�ﵽƽ��ʱ�����ܳ��ֵ������ǣ� ��
A. c��SO3����0.4 mol��L��1B. c��SO2����c��SO3����0.15 mol��L��1
C. c��O2����0.1 mol��L��1D. c��SO2����c��SO3����0.4 mol��L��1
���𰸡�D
��������
��ѧƽ��Ľ������ȿ��Դ�����Ӧ��ʼ��Ҳ���Դ��淴Ӧ��ʼ�����ߴ����淴Ӧ��ʼ�����۴��ĸ�����ʼ�����ʶ�������ȫ��Ӧ�����ü���������ȫ��Ӧ���������Ӧ���ʵ�Ũ�ȱ仯����ʵ�ʱ仯��С�ڼ���ֵ��������Ԫ���غ㣬c��SO3��+c��SO2��֮�Ͳ��䣬�ݴ��жϷ�����
A.SO3��Ũ������˵���÷�Ӧ������Ӧ������н���ƽ�⣬�����������������ȫ��Ӧ���ɷ���ʽ2SO2 ��g��+O2��g��![]() 2SO3��g����֪SO3��Ũ�ȱ仯Ϊ0.2mol/L��ʵ�ʱ仯С�ڸ�ֵ����c��SO3��С��0.4 mol/L����A����
2SO3��g����֪SO3��Ũ�ȱ仯Ϊ0.2mol/L��ʵ�ʱ仯С�ڸ�ֵ����c��SO3��С��0.4 mol/L����A����
B.������Ԫ���غ㣬c��SO3��+c��SO2��=0.2mol/L+0.2mol/L=0.4mol/L����B����
C.O2��Ũ�ȼ�С��˵����Ӧ������Ӧ������н���ƽ�⣬��SO2��ȫ��Ӧ���ɷ���ʽ2SO2 ��g��+O2��g��![]() 2SO3��g����֪O2��Ũ�ȱ仯Ϊ0.1mol/L��ʵ�ʱ仯ӦС�ڸ�ֵ����c��O2������0.1 mol/L����C����
2SO3��g����֪O2��Ũ�ȱ仯Ϊ0.1mol/L��ʵ�ʱ仯ӦС�ڸ�ֵ����c��O2������0.1 mol/L����C����
D.������Ԫ���غ㣬c��SO3��+c��SO2��=0.2mol/L+0.2mol/L=0.4mol/L����D��ȷ��
��ѡD��

����Ŀ�������飨![]() -C2H5�����������ϵ��屽��ϩ��
-C2H5�����������ϵ��屽��ϩ��![]() -CH=CH2������ԭ����Ӧ�ǣ�
-CH=CH2������ԭ����Ӧ�ǣ�![]() -C2H5(g)
-C2H5(g) ![]()
![]() -CH=CH2(g) + H2(g)����H = +125 kJ��mol-1��ij�¶��£���0.40 mol
-CH=CH2(g) + H2(g)����H = +125 kJ��mol-1��ij�¶��£���0.40 mol![]() -C2H5(g)����2L����ܱ������з�����Ӧ���ⶨ�������ڵ����ʣ��õ��������±���
-C2H5(g)����2L����ܱ������з�����Ӧ���ⶨ�������ڵ����ʣ��õ��������±���
ʱ��/min | 0 | 10 | 20 | 30 | 40 |
n( | 0.40 | 0.30 | 0.26 | n2 | n3 |
n( | 0.00 | 0.10 | n1 | 0.16 | 0.16 |
��1��n1=__________mol������÷�Ӧ��ƽ�ⳣ����K=___________��
��2����ҵ�ϳ��Ը���ˮ������Ϊ��Ӧ��ϵ��ϡ�ͼ��������뷴Ӧ����![]() -C2H5(g)��ƽ��ת������ˮ��������������ϵ��ѹǿ�Ĺ�ϵ��ͼ��ʾ����������������ʱ��ˮ����������Խ��ƽ��ת���ʽ�_________������Խ��������ԽС����������������ԭ����____________��
-C2H5(g)��ƽ��ת������ˮ��������������ϵ��ѹǿ�Ĺ�ϵ��ͼ��ʾ����������������ʱ��ˮ����������Խ��ƽ��ת���ʽ�_________������Խ��������ԽС����������������ԭ����____________��

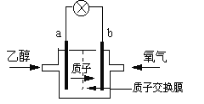
��3��������H2��������ȼ�ϵ�ء�д�����������£��õ�������ĵ缫��Ӧʽ__________��
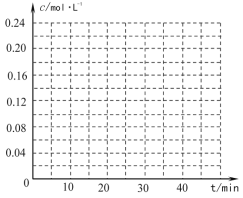
��4������ͬ�����£��������������г���![]() -CH=CH2(g)��H2(g)��������40minʱ�ﵽ����ͬ����ƽ��״̬������ͼ�л�����������������
-CH=CH2(g)��H2(g)��������40minʱ�ﵽ����ͬ����ƽ��״̬������ͼ�л�����������������![]() -C2H5(g)��
-C2H5(g)��![]() -CH=CH2(g)��Ũ��c��ʱ��t�仯������_____��
-CH=CH2(g)��Ũ��c��ʱ��t�仯������_____��