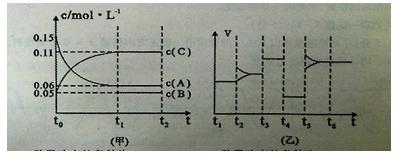
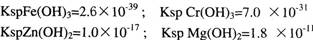题目内容
在一定温度下,氯化银饱和溶液中C(Ag+)·C(Cl-) = Ksp。现将足量AgCl固体分别加入下列物质中,各种溶液中AgCl的溶解度最大的是
A.20ml 0.1mol/LHCl溶液 B.30ml 0.2mol/LHCl溶液
C.40ml蒸馏水 D.50ml 0.05mol/LNaCl溶液
A.20ml 0.1mol/LHCl溶液 B.30ml 0.2mol/LHCl溶液
C.40ml蒸馏水 D.50ml 0.05mol/LNaCl溶液
C
由浓度积可知,溶液中的c(Cl-)越大,AgCl的溶解度越小,而各选项中的c(Cl-)依次为:0.1mol/L、0.2mol/L、0、0.05mol/L,故选项C符合题意

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案
相关题目
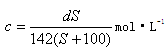
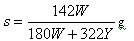
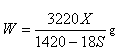

 应:Br2 +2Fe2+=2 Br -+2Fe3+,向10 mL0 .1mol/L的Fe Br2溶液中通入0 .003mol Cl2,该反应的离子方程式为
应:Br2 +2Fe2+=2 Br -+2Fe3+,向10 mL0 .1mol/L的Fe Br2溶液中通入0 .003mol Cl2,该反应的离子方程式为  现纳米级的Cu2O可作为太阳光分解水的催化剂。
现纳米级的Cu2O可作为太阳光分解水的催化剂。 ,在2L密闭容器中加入纳米级的Cu2O并通入0 .1mol水蒸气,发生反应:
,在2L密闭容器中加入纳米级的Cu2O并通入0 .1mol水蒸气,发生反应: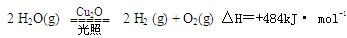 2 H2O(g)
2 H2O(g)