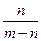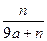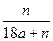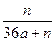��Ŀ����
(1)����ʱ�������Ƶ��ܶȻ�KSP =4.7��10-6, ����ʱ��9 mL0.02 mol��L��1���Ȼ�����Һ��1 mL
pH=13������������Һ��Ϻ�(��Һ�����ֱ�ӼӺ�),��Һ�� ��������(���л���).
(2)2��24������״̬������ͨ��250mL Ũ��Ϊ0.1 mol��L��1��������Һ��,��ַ�Ӧ����Һ�и�����Ũ�ȴ�СΪ (���ɴ�С��˳��д�������ӷ���)
(3) ����ѪҺ��Ca2+���ֳ�ȡij��Ѫ��10 mL��ϡ�ͺ��ò����[(NH4)2C2O4]��Һ������ʹCa2+��ȫת��Ϊ�����(CaC2O4)���������ˣ�ϴ�ӣ����õ��ij�����ϡ�����ܽ�õ�����(H2C2O4)��Һ����5.0��10-3 mol��L-1 KMnO4��Һ�ζ��õ��IJ������յ�,����ȥ2.0 mL KMnO4��Һ��������ʵ�����ݿ���ô���ѪҺ��Ca2+�����ʵ���Ũ��Ϊ .(��ʾ��2 KMnO4 + 5H2C2O4 + 3H2SO4 = 2MnSO4 + K2SO4 + 10CO2����8H2O)
(4)����ͼ�����Ӧʵ��.
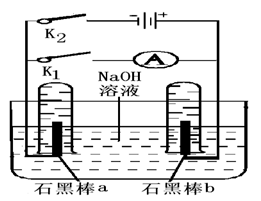
�ٶϿ�K1,�պ�K2��ֱͨ����Դ,д������ �ĵ缫��Ӧ .
�����ܷ�Ӧ����ʽ
�ڵ��һ��ʱ���,����ʯī�����������Χʱ,�ж�K2�պ�K1,���ֵ�·���е���ͨ��. д��a���ĵ缫��Ӧʽ
pH=13������������Һ��Ϻ�(��Һ�����ֱ�ӼӺ�),��Һ�� ��������(���л���).
(2)2��24������״̬������ͨ��250mL Ũ��Ϊ0.1 mol��L��1��������Һ��,��ַ�Ӧ����Һ�и�����Ũ�ȴ�СΪ (���ɴ�С��˳��д�������ӷ���)
(3) ����ѪҺ��Ca2+���ֳ�ȡij��Ѫ��10 mL��ϡ�ͺ��ò����[(NH4)2C2O4]��Һ������ʹCa2+��ȫת��Ϊ�����(CaC2O4)���������ˣ�ϴ�ӣ����õ��ij�����ϡ�����ܽ�õ�����(H2C2O4)��Һ����5.0��10-3 mol��L-1 KMnO4��Һ�ζ��õ��IJ������յ�,����ȥ2.0 mL KMnO4��Һ��������ʵ�����ݿ���ô���ѪҺ��Ca2+�����ʵ���Ũ��Ϊ .(��ʾ��2 KMnO4 + 5H2C2O4 + 3H2SO4 = 2MnSO4 + K2SO4 + 10CO2����8H2O)
(4)����ͼ�����Ӧʵ��.

�ٶϿ�K1,�պ�K2��ֱͨ����Դ,д������ �ĵ缫��Ӧ .
�����ܷ�Ӧ����ʽ
�ڵ��һ��ʱ���,����ʯī�����������Χʱ,�ж�K2�պ�K1,���ֵ�·���е���ͨ��. д��a���ĵ缫��Ӧʽ
(1)��(3��)
(2)NH4+;SO42-;OH-;H+ (3��)
(3) 2.5��10-3 mol��L-1 (3��)
(4) ��4OH-��2H2O+O2��+4e- (3��); 2H2O 2H2��+O2��(3��)
2H2��+O2��(3��)
�� 2H2+4OH���� 4H2O+4e- (3��)
(2)NH4+;SO42-;OH-;H+ (3��)
(3) 2.5��10-3 mol��L-1 (3��)
(4) ��4OH-��2H2O+O2��+4e- (3��); 2H2O
 2H2��+O2��(3��)
2H2��+O2��(3��)�� 2H2+4OH���� 4H2O+4e- (3��)
��

��ϰ��ϵ�д�
�����Ŀ
 Ba2+(aq)+2OH��(aq)�����������Һ�м�������������������ĩ������������ȷ���� ( )
Ba2+(aq)+2OH��(aq)�����������Һ�м�������������������ĩ������������ȷ���� ( ) �����������ʺ��ܽ���������
�����������ʺ��ܽ��������� һԪ����HA��aq���д������е���ƽ�⣺HA
һԪ����HA��aq���д������е���ƽ�⣺HA H+��A-����ͼ��1.0 mol HA���Ӽ���1.0 Lˮ�У���Һ��HA��H+��A-�����ʵ���Ũ����ʱ����仯��������ȷ����
H+��A-����ͼ��1.0 mol HA���Ӽ���1.0 Lˮ�У���Һ��HA��H+��A-�����ʵ���Ũ����ʱ����仯��������ȷ����