题目内容
下表是元素周期表的一部分,根据下表用元素符号或化学式填空:
(1)这九种元素分别为A
F
(2)A、C、D三种元素的氧化物对应的水化物,其中碱性最强的是
(3)A、B、C三种元素按原子半径由大到小的顺序排列为
(4)写出F元素的氢化物在常温下跟B元素的单质发生反应的化学方程式并标出电子转移的方向和数目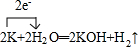
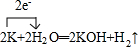 .
.
(5)H元素跟A元素形成化合物的电子式是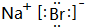
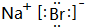 .高温灼烧该化合物时,火焰呈
.高温灼烧该化合物时,火焰呈
(6)H元素和G元素两者核电荷数之差是
| 主族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | E | F | ||||||
| 3 | A | C | D | G | R | |||
| 4 | B | H |
Na
Na
、BK
K
、CMg
Mg
、DAl
Al
、EC
C
、F
O
O
、GCl
Cl
、HBr
Br
、RAr
Ar
,其中化学性质最不活泼的是Ar
Ar
.(2)A、C、D三种元素的氧化物对应的水化物,其中碱性最强的是
NaOH
NaOH
.(3)A、B、C三种元素按原子半径由大到小的顺序排列为
K+>Na+>Mg2+
K+>Na+>Mg2+
.(4)写出F元素的氢化物在常温下跟B元素的单质发生反应的化学方程式并标出电子转移的方向和数目
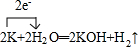
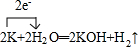
(5)H元素跟A元素形成化合物的电子式是
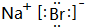
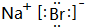
黄
黄
色.(6)H元素和G元素两者核电荷数之差是
18
18
.分析:由元素在周期表中的位置可知,A为Na,B为K,C为Mg,D为Al,E为C,F为O,G为Cl,H为Br,R为Ar,
(1)化学性质最不活泼的是零族元素;
(2)同周期自左而右金属性减弱,金属性越强最高价氧化物对应水化物的碱性越强;
(3)电子层结构相同核电荷数越大离子半径越小,电子层越多离子半径越大;
(4)K与水反应生成氢氧化钾与氢气,反应中转移电子数为2,用单线桥表示应由失电子的原子指向得电子原子,据此标出电子转移的方向与数目;
(5)H元素跟A元素形成化合物为NaBr,属于离子化合物,含有钠元素,焰色反应为黄色;
(6)Cl与Br同主族相邻,二者原子序数形成18.
(1)化学性质最不活泼的是零族元素;
(2)同周期自左而右金属性减弱,金属性越强最高价氧化物对应水化物的碱性越强;
(3)电子层结构相同核电荷数越大离子半径越小,电子层越多离子半径越大;
(4)K与水反应生成氢氧化钾与氢气,反应中转移电子数为2,用单线桥表示应由失电子的原子指向得电子原子,据此标出电子转移的方向与数目;
(5)H元素跟A元素形成化合物为NaBr,属于离子化合物,含有钠元素,焰色反应为黄色;
(6)Cl与Br同主族相邻,二者原子序数形成18.
解答:解:由元素在周期表中的位置可知,A为Na,B为K,C为Mg,D为Al,E为C,F为O,G为Cl,H为Br,R为Ar,
(1)由元素在周期表中的位置可知,A为Na,B为K,C为Mg,D为Al,E为C,F为O,G为Cl,H为Br,R为Ar;零族元素最外层为稳定结构,故化学性质最不活泼的是Ar,
故答案为:Na;K;Mg;Al;C;O;Cl;Br;Ar;Ar;
(2)同周期自左而右金属性减弱,故金属性Na>Mg>Al,金属性越强最高价氧化物对应水化物的碱性越强,故NaOH碱性最强,故答案为:NaOH;
(3)电子层结构相同核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径K+>Na+>Mg2+,故答案为:K+>Na+>Mg2+;
(4)K与水反应生成氢氧化钾与氢气,方程式为2K+2H2O═2KOH+H2↑,反应中转移电子数为2,标出电子转移的方向与数目为: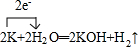 ,故答案为:
,故答案为: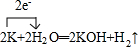 ;
;
(5)H元素跟A元素形成化合物为NaBr,属于离子化合物,其电子式为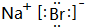 ,含有钠元素,焰色反应为黄色,故答案为:
,含有钠元素,焰色反应为黄色,故答案为: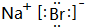 ;黄;
;黄;
(6)Cl与Br同主族相邻,二者原子序数形成18,故答案为:18.
(1)由元素在周期表中的位置可知,A为Na,B为K,C为Mg,D为Al,E为C,F为O,G为Cl,H为Br,R为Ar;零族元素最外层为稳定结构,故化学性质最不活泼的是Ar,
故答案为:Na;K;Mg;Al;C;O;Cl;Br;Ar;Ar;
(2)同周期自左而右金属性减弱,故金属性Na>Mg>Al,金属性越强最高价氧化物对应水化物的碱性越强,故NaOH碱性最强,故答案为:NaOH;
(3)电子层结构相同核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径K+>Na+>Mg2+,故答案为:K+>Na+>Mg2+;
(4)K与水反应生成氢氧化钾与氢气,方程式为2K+2H2O═2KOH+H2↑,反应中转移电子数为2,标出电子转移的方向与数目为:
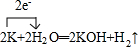 ,故答案为:
,故答案为: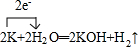 ;
;(5)H元素跟A元素形成化合物为NaBr,属于离子化合物,其电子式为
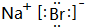 ,含有钠元素,焰色反应为黄色,故答案为:
,含有钠元素,焰色反应为黄色,故答案为: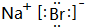 ;黄;
;黄;(6)Cl与Br同主族相邻,二者原子序数形成18,故答案为:18.
点评:本题考查元素周期表与元素周期律的综合应用,侧重常用化学用语与元素周期律的考查,难度不大,注意掌握氧化还原反应中单线桥与双线桥表示方法.

练习册系列答案
相关题目



 NH4++OH-,试判断NH3溶于水后,形成的NH3?H2O的合理结构是
NH4++OH-,试判断NH3溶于水后,形成的NH3?H2O的合理结构是 (4)1906年的诺贝尔化学奖授予为制备F2单质作出重要贡献的化学家莫瓦桑,请预测首先被用来与F2反应制备稀有气体化合物的元素是
(4)1906年的诺贝尔化学奖授予为制备F2单质作出重要贡献的化学家莫瓦桑,请预测首先被用来与F2反应制备稀有气体化合物的元素是