题目内容
把氢气和氮气以1∶1的物质的量之比放入一容积固定的容器中,测得平衡时氮气的转化率为20%时,求:
(1)反应前后的压强之比。
(2)平衡时混合气体的平均相对分子质量。
(1)5∶4 (2)18.75
解析:
假设反应前N2、H2均为1 mol,则平衡时消耗的N2、H2分别为0.2 mol、0.6 mol,生产的NH3为0.4 mol。所以反应前后气体的压强之比为:2 mol∶1.6 mol=5∶4。平衡时混合气体的平均相对分子质量为:
M=![]() =18.75。
=18.75。

练习册系列答案
相关题目
工业合成氨与制备硝酸一般可连续生产,流程如下:
(1)某温度下体积为200L的氨合成塔中,测得如下数据:
根据表中数据计算0~2小时内N2的平均反应速率 mol?L-1?h-1
若起始时与平衡时的压强之比为a,则N2的转化率为 (用含a的代数式表示)
(2)希腊阿里斯多德大学的 George Marnellos 和 Michael Stoukides,发明了一种合成氨的新方法(Science,2,Oct.1998,p98),在常压下,把氢气和用氦气稀释的氮气分别通入一个加热到570℃的电解池,利用能通过氢离子的多孔陶瓷固体作电解质,氢气和氮气在电极上合成了氨,转化率达到78%,试写出电解池阴极的电极反应式
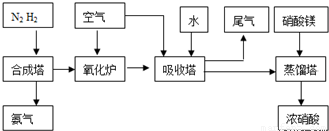
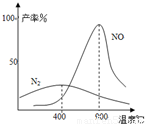
(3)氨气和氧气从145℃就开始反应,在不同温度和催化剂条件下生成不同产物(如图):
4NH3+5O2?4NO+6H2O K1=1×1053(900℃)
4NH3+3O2?2N2+6H2O K2=1×1067(900℃)温度较低时以生成 为主,温度高于900℃时,NO产率下降的原因 .吸收塔中需要补充空气的原因 .
(4)尾气处理时小型化工厂常用尿素作为氮氧化物的吸收剂,此法运行费用低,吸收效果好,不产生二次污染,吸收后尾气中NOx的去除率高达99.95%.其主要的反应为氮氧化物混合气与水反应生成亚硝酸,亚硝酸再与尿素反应生成CO2和N2请写出有关反应化学方程式 , .

(1)某温度下体积为200L的氨合成塔中,测得如下数据:
| 时间(h)浓度(mol/L) | 1 | 2 | 3 | 4 | |
| N2 | 1.500 | 1.400 | 1.200 | C1 | C1 |
| H2 | 4.500 | 4.200 | 3.600 | C2 | C2 |
| NH3 | 0.200 | 0.600 | C3 | C3 |
若起始时与平衡时的压强之比为a,则N2的转化率为 (用含a的代数式表示)
(2)希腊阿里斯多德大学的 George Marnellos 和 Michael Stoukides,发明了一种合成氨的新方法(Science,2,Oct.1998,p98),在常压下,把氢气和用氦气稀释的氮气分别通入一个加热到570℃的电解池,利用能通过氢离子的多孔陶瓷固体作电解质,氢气和氮气在电极上合成了氨,转化率达到78%,试写出电解池阴极的电极反应式
(3)氨气和氧气从145℃就开始反应,在不同温度和催化剂条件下生成不同产物(如图):
4NH3+5O2?4NO+6H2O K1=1×1053(900℃)
4NH3+3O2?2N2+6H2O K2=1×1067(900℃)温度较低时以生成 为主,温度高于900℃时,NO产率下降的原因 .吸收塔中需要补充空气的原因 .
(4)尾气处理时小型化工厂常用尿素作为氮氧化物的吸收剂,此法运行费用低,吸收效果好,不产生二次污染,吸收后尾气中NOx的去除率高达99.95%.其主要的反应为氮氧化物混合气与水反应生成亚硝酸,亚硝酸再与尿素反应生成CO2和N2请写出有关反应化学方程式 , .

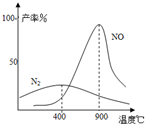 (2009?中山模拟)工业合成氨与制备硝酸一般可连续生产,流程如下:
(2009?中山模拟)工业合成氨与制备硝酸一般可连续生产,流程如下: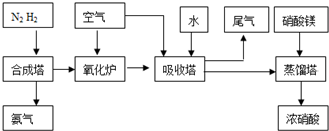
 此条件下,该反应达到化学平衡时,氮气的浓度为
此条件下,该反应达到化学平衡时,氮气的浓度为