题目内容
已知16S、34Se位于同一主族,下列关系正确的是
A.热稳定性:H2Se> H2S> HClB.原子半径:Se>P>Si
C.酸性:H3PO4>H2SO4>H2SeO4 D.还原性:Se2->Br->Cl-
D
【解析】
试题分析:A、Se 、S、Cl的非金属性逐渐增强,其气态氢化物的稳定性逐渐增强,错误;B、P、Si是同周期元素,核电荷数越小半径越大,所以P<Si,错误;C、P的非金属性弱于S的非金属性,所以最高价含氧酸的酸性H3PO4<H2SO4,错误;D、Se、Br、Cl的氧化性逐渐增强,所以其简单阴离子的还原性逐渐减弱,正确,答案选D。
考点:考查元素周期律的应用

 阅读快车系列答案
阅读快车系列答案| A、热稳定性:HF>HC1>H2S | B、原子半径:Br>Se>Cl | C、还原性:S2->Se2->Cl- | D、酸性:HBrO4>HClO4>H2SO4 |
| A、热稳定性:H2Se>H2S>HCl | B、原子半径:Se>P>Si | C、酸性:H3PO4>H2SO4>H2SeO4 | D、还原性:Se2->Br->Cl- |
下表是氧族元素的相关性质
| 性质\元素 | 8O | 16S | 34Se | 52Te |
| 单质熔点(℃) | ―218.4 | 113 | 450 | |
| 单质沸点(℃) | ―183 | 444.6 | 685 | 1390 |
| 主要化合价 | ―2 | ―2,+4,+6 | ―2,+4,+6 | |
| 原子半径 | 逐渐增大 | |||
| 单质与H2反应情况 | 点燃时易化合 | 加热化合 | 加热难化合 | 不能直接化合 |
请根据表回答下列问题:
(1)硒的熔点范围可能是
(2)氢硒酸有较强的 (填“氧化性”或“还原性”),因此放在空气中长期保存易变质,其可能发生在化学反应方程式为 。
(3)工业上Al2Te3可用来制备H2Te,完成下列化学方程式:
□Al2Te3+□ ===Al(OH)3↓+□H2Te↑
(4)已知在常温下,H2和S反应生成17gH2S放出56.1KJ的热量,试写出硫化氢分解的热化学方程式: 。
(5)右图所示为氧族元素单质与H2反应过程中的
能量变化示意图,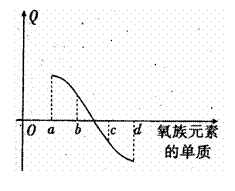 其中a、b、c、d分另表示
其中a、b、c、d分另表示
氧族中某一元素的单质,Q为相同物质的量
的单质与H2反应放出的热量。则:
a代表 ,c代表
(均可单质名称)
 归纳整理是科学学习的重要方法之一.在学习了氧族元素的各种性质后,可归纳整理出如下表所示的表格(部分).
归纳整理是科学学习的重要方法之一.在学习了氧族元素的各种性质后,可归纳整理出如下表所示的表格(部分).