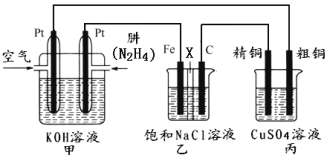
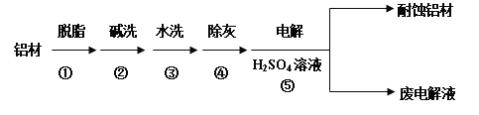
题目内容
【题目】铍及其化合物的应用正日益被重视。在周期表中,同一主族元素化学性质相似。目前也发现有些元素的化学性质和它在周期表中左上方或右下方的另一主族元素性质相似,这称为对角线规则。据此请回答:
(1)锂在空气中燃烧,除生成Li2O外,也生成微量的_________(填化学式)。
(2)铍的最高价氧化物对应的水化物属两性化合物,证明这一结论的有关离子方程式为_______________________________________________________________。
(3)氯化铍在气态时存在BeCl2分子(a)和二聚分子(BeCl2)2(b),a属于________(填“离子”或“共价”)化合物,写出它的一个等电子体_________。
(4)二聚分子(BeCl2)2中Be原子的杂化方式相同,且所有原子都在同一平面上。b 的结构式为__________(标出配位键)。
【答案】Li3N Be(OH)2+2H+===Be2++2H2O、Be(OH)2+2OH-===BeO22-+2H2O 共价 CO2或N2O ![]()
【解析】
(1)Li和Mg处于对角线位置,镁在空气中燃烧生成氧化镁、氮化镁。所以锂在空气中燃烧,除生成Li2O外,也生成微量的Li3N,故答案为:Li3N。
(2)Be的化合价是+2,铍的最高价氧化物对应的水化物的化学式为Be(OH)2,根据两性氢氧化物既能与酸反应生成盐和水,又能和碱(强碱)反应生成盐和水,有关离子方程式如下,Be(OH)2+2H+=Be2++2H2O、Be(OH)2+2OH-=BeO22-+2H2O,
故答案为:Be(OH)2+2H+=Be2++2H2O;Be(OH)2+2OH-=BeO22-+2H2O。
(3)铍和铝在周期表是对角线位置,根据对角线规则,氯化铍和三氯化铝类似,AlCl3为共价化合物,则BeCl2也为共价化合物;根据等电子体的概念:原子总数相同、电子总数或价电子总数相同的互为等电子体,BeCl2分子的等电子体为CO2或N2O,故答案为:共价,CO2或N2O。
(4)在二聚分子(BeCl2)2中Be原子有空轨道,Cl原子有孤对电子,则配位键中电子对由氯原子提供,b的结构式为![]() ,故答案为:
,故答案为:![]() 。
。