题目内容
将1molNa和1molAl的混合物投入足量水中,产生气体在标准状况下的体积为
- A.11.2L
- B.22.4L
- C.33.6L
- D.44.8L
D
分析:首先发生反应:2Na+2H2O=2NaOH+H2↑,根据钠计算生成氢气、氢氧化钠的物质的量,然后发生2Al+2NaOH+2H2O═2NaAlO2+3H2↑,进行过量计算,根据不足量的物质的量计算生成氢气的物质的量,两部分氢气之和为总的氢气的物质的量,再个V=nVm计算体积.
解答:首先1molNa与水反应,则:
2Na+2H2O=2NaOH+H2↑
1mol 1mol 0.5mol
然后发生反应2Al+2NaOH+2H2O═2NaAlO2+3H2↑,由方程式可知1molAl消耗1molNaOH,故Al与NaOH恰好完全反应,生成氢气为1mol×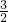 =1.5mol,
=1.5mol,
故生成氢气的总体积为(0.5mol+1.5mol)×22.4L/mol=44.8L,
故选D.
点评:本题考查混合物的有关计算,难度不大,清楚发生的反应是关键,注意铝与氢氧化钠反应的过量计算.
分析:首先发生反应:2Na+2H2O=2NaOH+H2↑,根据钠计算生成氢气、氢氧化钠的物质的量,然后发生2Al+2NaOH+2H2O═2NaAlO2+3H2↑,进行过量计算,根据不足量的物质的量计算生成氢气的物质的量,两部分氢气之和为总的氢气的物质的量,再个V=nVm计算体积.
解答:首先1molNa与水反应,则:
2Na+2H2O=2NaOH+H2↑
1mol 1mol 0.5mol
然后发生反应2Al+2NaOH+2H2O═2NaAlO2+3H2↑,由方程式可知1molAl消耗1molNaOH,故Al与NaOH恰好完全反应,生成氢气为1mol×
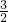 =1.5mol,
=1.5mol,故生成氢气的总体积为(0.5mol+1.5mol)×22.4L/mol=44.8L,
故选D.
点评:本题考查混合物的有关计算,难度不大,清楚发生的反应是关键,注意铝与氢氧化钠反应的过量计算.

练习册系列答案
相关题目
用NA代表阿伏加德罗常数,下列说法正确的是( )
| A.常温下,2LpH=12的Na2CO3溶液中含有的OH—数目为0.02NA |
| B.5.6gFe粉在0.1molCl2中充分燃烧,转移电子数为0.3NA |
| C.将100mL 1mol/LFeCl3溶液滴入沸水中,生成胶体粒子0.1NA |
| D.0.1molNa与O2反应生成Na2O和Na2O2时,转移电子数0.2NA |