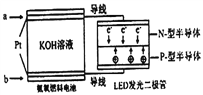
��Ŀ����
����Ŀ����ҵ�����õ�ⱥ��ʳ��ˮ��������(Cl2)���ռ�������Ļ�ѧ����ʽ��:2NaCl + 2H2O![]() 2NaOH + Cl2��+ H2��
2NaOH + Cl2��+ H2��
��1����˫���ű�ʾ������ת�Ƶķ������Ŀ______________������з�Ӧ��д�����ӷ���ʽ��___________________________________
��2�����ʳ��ˮ�Ĺ����У�����������__________________________________
��3�����ʳ��ˮҪ��Դ�ʳ��ˮ���о��ƣ��Գ�ȥ��ʳ��ˮ�к��е���ɳ��SO42-��Ca2+,Mg2+���������ӡ�����ʱ���μ����Ȼ�����Һ������ռ��ַ�Ӧ����ˣ�����Һ�м��������к������ԡ���������Һ��Ӧ�����ӷ���ʽ:____________________________
���𰸡�  2Cl-+2H2O
2Cl-+2H2O![]() 2OH- +Cl2��+ H2�� ����(��Cl2) H++OH-
2OH- +Cl2��+ H2�� ����(��Cl2) H++OH-![]() H2O CO32- +2H+
H2O CO32- +2H+ ![]() CO2��+ H2O
CO2��+ H2O
��������(1)����Ȼ�����Һʱ������1mol������Ҫ2mol���ӣ�����1mol������Ҫ2mol���ӣ�������ת�Ƶ�������2������ת�Ʒ������ĿΪ �����ӷ���ʽΪ��2Cl-+2H2O
�����ӷ���ʽΪ��2Cl-+2H2O![]() 2OH-+Cl2��+H2�����ʴ�Ϊ��
2OH-+Cl2��+H2�����ʴ�Ϊ�� ��2Cl-+2H2O
��2Cl-+2H2O![]() 2OH-+Cl2��+H2����
2OH-+Cl2��+H2����
(2)��Ӧ2NaCl+2H2O![]() 2NaOH+Cl2��+H2���У����ϼ����ߵ�ClԪ�ر���������������������Ϊ��������ʴ�Ϊ������(��Cl2)��
2NaOH+Cl2��+H2���У����ϼ����ߵ�ClԪ�ر���������������������Ϊ��������ʴ�Ϊ������(��Cl2)��
(3)���ʳ��ˮҪ��Դ�ʳ��ˮ���о��ƣ��Գ�ȥ��ʳ��ˮ�к��е���ɳ��SO42-��Ca2+��Mg2+���������ӡ�����ʱ���μ����Ȼ�����Һ����ȥ��������ӣ����봿���ȥ�����Ӻ����ı����ӣ������ռ��ȥþ���ӣ���ַ�Ӧ����ˣ���Һ����Ҫ���й�����̼���ƺ��������ƣ����������к�����������Ӧ�����ӷ���ʽ��H++OH-=H2O��CO32- +2H+ =CO2��+ H2O���ʴ�Ϊ��H++OH-=H2O��CO32- +2H+ =CO2��+ H2O��

 ��Уͨ��֤��Ч��ҵϵ�д�
��Уͨ��֤��Ч��ҵϵ�д�����Ŀ���ο����У�a������c����ش����⣺
��a������ֵ��ʹ1g��֬��������Ҫ��KOH�ĺ�������
��b����ֵ��ʹ100g��֬�ӳɵ�Ŀ�����
��c��������֬������ֵ����ֵ�б����£�
������ | �������� | ţ�� | ���� | Ӳ������ | ���� | |
����ֵ | 190 | 180 | 195 | 226 | 193 | 193 |
��ֵ | 90 | 182 | 38 | 38 | 5 | 126 |
��1�������ɣ�C17H33COO��3C3H5����Է�������884���γɵ��ͣ�����ֵ��
��2���ں����������ʵ��Ĵʾ䣺
�������ͱȻ������������࣬���ͱ�ţ�͵�С��Ӳ�����͵ĵ�ֵС��ԭ���� ��
��3��Ϊʹ��ֵΪ180������100gӲ������Ҫ��H2�����Ϊ������״���£���
��4���ṹ��ʽΪ ![]() ������������ֵΪ430����nΪ ��
������������ֵΪ430����nΪ ��
����Ŀ��CO��NO2���ж������ת���Լ����Ļ�����ϳɡ�Ӧ�ü����Ĺ̶�һֱ�ǿ�ѧ�о����ȵ㡣
��1����CO2��NH3Ϊԭ�Ϻϳɻ�������[CO(NH2)2]����Ҫ��Ӧ���£�
��2NH3(g)+CO2(g)=NH2CO2NH4(s) ��H= -159.47kJ��mol-1
��NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) ��H=akJ��mol-1
��2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g) ��H= -86.98kJ��mol-1
��a=_______��
��2����Ӧ2NH3(g)+CO2(g)![]() CO(NH2)2��1��+H2O(g)���ںϳ����н��С���ͼ��I��II��III��������Ϊ�ϳ����а���ͬ��̼�Ⱥ�ˮ̼��Ͷ��ʱ������̼ת���ʵ����������I��II��IIIˮ̼�ȵ���ֵ�ֱ�Ϊ��
CO(NH2)2��1��+H2O(g)���ںϳ����н��С���ͼ��I��II��III��������Ϊ�ϳ����а���ͬ��̼�Ⱥ�ˮ̼��Ͷ��ʱ������̼ת���ʵ����������I��II��IIIˮ̼�ȵ���ֵ�ֱ�Ϊ��
I��0.6��0.7 II��1��1.1 III��1.5��1.61
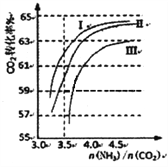
������Ӧѡ��ˮ̼�ȵ���ֵΪ__________(ѡ�����)��
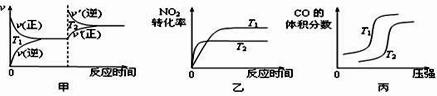
��3��4CO(g)��2NO2(g) ![]() 4CO2(g)��N2(g) ��H��-1200 kJ��mol-1 �����ڸ÷�Ӧ���¶Ȳ�ͬ��T2��T1��������������ͬʱ������ͼ����ȷ����_____������ţ���
4CO2(g)��N2(g) ��H��-1200 kJ��mol-1 �����ڸ÷�Ӧ���¶Ȳ�ͬ��T2��T1��������������ͬʱ������ͼ����ȷ����_____������ţ���
��4���û���̿��ԭ��Ҳ���Դ����������ij�о�С����ij�ܱ���������һ�����Ļ���̿��NO��������ӦC(s)+2NO(g) ![]() N2(g)+CO2(g) ��H��T1��ʱ����Ӧ���е���ͬʱ���ø����ʵ���Ũ�����£�
N2(g)+CO2(g) ��H��T1��ʱ����Ӧ���е���ͬʱ���ø����ʵ���Ũ�����£�
Ũ��/(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.0 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
��30min��ֻ�ı�ijһ�����������ϱ��������жϸı������������_______������ĸ���ţ���
a.����һ�����Ļ���̿ b.ͨ��һ������NO
c.�ʵ���С��������� d.������ʵĴ���
����30min�������¶���T2�����ﵽƽ��ʱ��������NO��N2��CO2��Ũ��֮��Ϊ5:3:3����ﵽ��ƽ��ʱNO��ת����_________����������������������������H___________0������>������<����.
��5��һ�ְ�ȼ�ϵ�أ�ʹ�õĵ������Һ��2mol/L��KOH��Һ����ط�ӦΪ��4NH3+3O2=2N2+6H2O����д��ͨ��a����һ���ĵ缫��ӦʽΪ____________________