��Ŀ����
����Ŀ������X�������ֳ���Ԫ����ɵĻ�������н���Ԫ������һԪ�ص�������Ϊ14��1����һ��������X�ɷ�����ͼ��ת����ϵ���еķ�Ӧ���ȫ������еķ�Ӧ������ֲ����֪PΪ�������R��һ����ɫ��ζ��ʹ����ʯ��ˮ����ǵ����壬CΪ���ɫ������MΪһ�ֳ����������ʡ�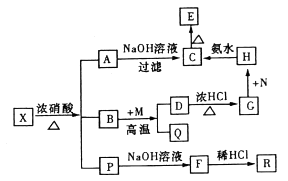
�Իش��������⣺
��1��X�Ļ�ѧʽΪ��
��2��ʵ��G��H�����������µ����ʣ�N����ѡ�����������е�������ţ���
��KMnO4 ��HNO3 ��H2O2 ��Cl2
��3��д������ת���Ļ�ѧ����ʽ��
B��D:��H��C����
��4����֪P����һ������������������Һ��Ӧ�������������Σ��÷�Ӧ�����ӷ���ʽΪ����
��5��X��Ũ������һ�������·�Ӧʱ������1 mol X������ʱ��ת�Ƶĵ�����ĿΪ��
���𰸡�
��1��Fe3C
��2���ۢ�
��3��3Fe+4H2O(g) ![]() Fe3O4 +4H2,3NH3��H2O +FeC13=Fe(OH)3��+3NH4Cl
Fe3O4 +4H2,3NH3��H2O +FeC13=Fe(OH)3��+3NH4Cl
��4��2NO2+2OH-=NO2-+NO3-+H2O
��5��13NA
�������������������ת����ϵ��R����ɫ��������ʹ����ʯ��ˮ����ǵ����壬�ж�ΪCO2����FӦΪ̼���Σ���P��Ӧ����̼Ԫ�أ�CΪ���ɫ����ΪFe��OH��3����A��H�ж����������ӣ�����AΪFe��NO3��3������X�������ֳ���Ԫ����ɵĻ�����ж�һ��������Ԫ�غ�̼Ԫ�أ����н���Ԫ������һԪ�ص�������Ϊ14��1����X��ѧʽΪFe3C������Ԫ���غ㣬B��Ӧ������Ԫ�أ�������MΪ�����������ʣ���B��Ӧ����Q��D������BΪH2O��QΪH2��H������Ԫ���жϣ�MΪ����Fe��DΪFe3O4��D�����ᷴӦ����GΪFeCl2��FeCl3��NΪCl2��G��N��Ӧ����HΪFeCl3��C��������EΪFe2O3��X��Ũ���ᷴӦ���ɻ������PӦΪCO2��NO2��
��1����������ķ�����֪��X�Ļ�ѧʽΪFe3C��
���Դ��ǣ�Fe3C��
��2��ʵ��FeCl2��FeCl3�����������µ����ʣ�N������H2O2��Cl2��
��ѡ�ۢܣ�
��3��MΪ����Fe��ˮ�����ڸ��·�Ӧ�Ļ�ѧ����ʽΪ3Fe+4H2O ![]() Fe3O4+4H2���Ȼ����백ˮ��Ӧ��������������������Ӧ�Ļ�ѧ����ʽΪ3NH3��H2O +FeC13=Fe(OH)3��+3NH4Cl ��
Fe3O4+4H2���Ȼ����백ˮ��Ӧ��������������������Ӧ�Ļ�ѧ����ʽΪ3NH3��H2O +FeC13=Fe(OH)3��+3NH4Cl ��
���Դ��ǣ�3Fe+4H2O ![]() Fe3O4+4H2��3NH3��H2O +FeC13=Fe(OH)3��+3NH4Cl��
Fe3O4+4H2��3NH3��H2O +FeC13=Fe(OH)3��+3NH4Cl��
��4��PΪCO2��NO2��P����һ������������������Һ��Ӧ�������������Σ���÷�ӦΪ�����������������Ʒ�Ӧ���������ƺ��������ƣ���Ӧ�����ӷ���ʽΪ2NO2+2OH-=NO2-+NO3-+H2O��
���Դ��ǣ�2NO2+2OH-=NO2-+NO3-+H2O��
(5) XΪFe3C����Ũ������һ�������·�Ӧʱ�������������Ͷ�����̼����1 mol Fe3C������ʱ��������Ԫ�صĻ��ϼ�Ϊ0�ۣ���Ӧ������0�۱��+3�ۣ�C��0�۱��+4�ۣ�ת�Ƶĵ��ӵ����ʵ���Ϊ3��3+4=14mol����ĿΪ13NA��
���Դ��ǣ�13NA��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
