题目内容
(7分)某化学兴趣小组为了探究在常温下某非金属氧化物形成的未知气体的成分。该小组成员将气体通入澄清石灰水,发现变浑浊,持续通入发现浑浊又变澄清,由此该小组成员对气体的成分提出猜想。
猜想1: ;
猜想2: ;
猜想3: 。
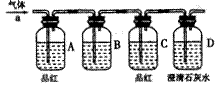
为了验证猜测,该小组设计实验加以探究:该小组同学按如图所示装置,将气体从a端通入,则:(1)B中应该装下列 试剂(填编号)
A.氢氧化钠溶液 B酸性高锰酸钾溶液
C.饱和碳酸钠溶液 D.饱和碳酸氢钠溶液
(2)A中品红的作用是:
(3)D中澄清石灰水的作用是:
通过该实验,该小组同学观察到以下三个实验现象:①A中品红褪色②C中品红不褪色③ D中澄清石灰水变浑浊。由此得出结论:该气体的成分为 。
猜想1: ;
猜想2: ;
猜想3: 。

为了验证猜测,该小组设计实验加以探究:该小组同学按如图所示装置,将气体从a端通入,则:(1)B中应该装下列 试剂(填编号)
A.氢氧化钠溶液 B酸性高锰酸钾溶液
C.饱和碳酸钠溶液 D.饱和碳酸氢钠溶液
(2)A中品红的作用是:
(3)D中澄清石灰水的作用是:
通过该实验,该小组同学观察到以下三个实验现象:①A中品红褪色②C中品红不褪色③ D中澄清石灰水变浑浊。由此得出结论:该气体的成分为 。
(7分)(每空1分)
该气体是SO2气体;该气体是CO2气体; 该气体是SO2,CO2的混合气体
(1)B (2)检验SO2的存在(3)检验CO2的存 在;该气体是SO2,CO2的混合气体
在;该气体是SO2,CO2的混合气体
该气体是SO2气体;该气体是CO2气体; 该气体是SO2,CO2的混合气体
(1)B (2)检验SO2的存在(3)检验CO2的存
 在;该气体是SO2,CO2的混合气体
在;该气体是SO2,CO2的混合气体略

练习册系列答案
 天天向上口算本系列答案
天天向上口算本系列答案
相关题目
 某研究性小组借助A-D的仪器装置(可以重复使用)完成有关实验
某研究性小组借助A-D的仪器装置(可以重复使用)完成有关实验





 微粒符号表示 );
微粒符号表示 ); _______________________________________________________________________
_______________________________________________________________________ Ⅰ.查阅资料:①Cu2O属于碱性氧化物; ②在空气中灼烧Cu2O生成CuO;③Cu2O在酸性条件下能发生下列反应:Cu2O+2H+=Cu+Cu2++H2O。
Ⅰ.查阅资料:①Cu2O属于碱性氧化物; ②在空气中灼烧Cu2O生成CuO;③Cu2O在酸性条件下能发生下列反应:Cu2O+2H+=Cu+Cu2++H2O。 验方案:
验方案:
