题目内容
【题目】信息时代产生的大量电子垃圾对环境构成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含70%Cu,25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:(友情提示:要将溶液中的![]() 、
、![]() 、
、![]() 、
、![]() 沉淀为氢氧化物,需溶液的pH分别为:6.4、6.4、3.7、4.7)
沉淀为氢氧化物,需溶液的pH分别为:6.4、6.4、3.7、4.7)
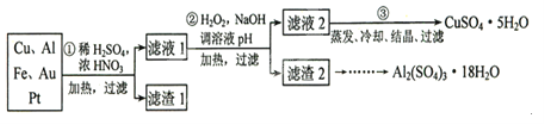
请回答下列问题:
(1)如何检验滤液1中是否含有![]() ?_______________;得到滤渣1的主要成分为____________。
?_______________;得到滤渣1的主要成分为____________。
(2)第2步加![]() 的作用是____________,使用
的作用是____________,使用![]() 的优点是____________;调溶液pH的目的是使____________生成沉淀。
的优点是____________;调溶液pH的目的是使____________生成沉淀。
(3)用第③步所得![]() 制备无水
制备无水![]() 的方法是____________。
的方法是____________。
(4)由滤渣2制取![]() ,探究小组设计了三种方案:
,探究小组设计了三种方案:
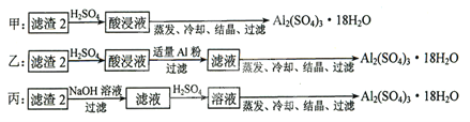
上述三种方案中,______方案不可行,原因是_________;从原子利用率角度考虑,______方案更合理。
(5)结晶水的测定:将坩埚洗净,烘干至恒重,记录质量;在坩埚中加入研细的三草酸合铁酸钾晶体,称量并记录质量;加热至250℃,恒温一段时间,置于空气中冷却,称量并记录质量;计算结晶水含量。请纠正实验过程中的两处错误:______________、______________。
【答案】取少量滤液1于试管中,加入KSCN溶液,若溶液呈现血红色就证明有![]() ,若溶液没有呈现血红色就无
,若溶液没有呈现血红色就无![]() Pt、Au 将
Pt、Au 将![]() 氧化为
氧化为![]() 不引入杂质,对环境无污染
不引入杂质,对环境无污染 ![]() 、
、![]() 加热脱水 甲 所得产品中含有较多
加热脱水 甲 所得产品中含有较多![]() 杂质 乙 样品加热后不应置于空气中冷却,应置于干燥器中冷却 样品“加热、冷却、称量”需进行多次直至恒重
杂质 乙 样品加热后不应置于空气中冷却,应置于干燥器中冷却 样品“加热、冷却、称量”需进行多次直至恒重
【解析】
在浓硝酸、稀硫酸和加热条件下,Cu、Al、Fe溶解,Au、Pt不溶解,经过滤得滤渣1为Au、Pt,滤液1为含Cu2+、Al3+、Fe2+、Fe3+、SO42-等离子的溶液,滤液1加H2O2将Fe2+氧化成Fe3+,然后加NaOH调pH到4.7将Al3+沉淀,同时Fe3+也被沉淀,得滤渣2为Al(OH)3和Fe(OH)3、滤液2主要含CuSO4溶液,滤液2经蒸发浓缩、冷却结晶、过滤得CuSO4·5H2O,滤渣2经一系列操作得![]() ,据此解答。
,据此解答。
(1)Fe3+用KSCN溶液检验,具体方法为:取少量滤液1于试管中,加入KSCN溶液,若溶液呈现血红色就证明有![]() ,若溶液没有呈现血红色就无Fe3+,滤渣1的主要成分为不溶于硝酸和硫酸的Pt、Au,故答案为:取少量滤液1于试管中,加入KSCN溶液,若溶液呈现血红色就证明有
,若溶液没有呈现血红色就无Fe3+,滤渣1的主要成分为不溶于硝酸和硫酸的Pt、Au,故答案为:取少量滤液1于试管中,加入KSCN溶液,若溶液呈现血红色就证明有![]() ,若溶液没有呈现血红色就无Fe3+;Pt、Au;
,若溶液没有呈现血红色就无Fe3+;Pt、Au;
(2)加H2O2的作用是将![]() 氧化为
氧化为![]() ,优点是还原产物为H2O,既不引入杂质,也不会对环境造成污染,调pH的目的是使
,优点是还原产物为H2O,既不引入杂质,也不会对环境造成污染,调pH的目的是使![]() 、
、![]() 形成沉淀,故答案为:将
形成沉淀,故答案为:将![]() 氧化为
氧化为![]() ;还原产物为H2O,既不引入杂质,也不会对环境造成污染;
;还原产物为H2O,既不引入杂质,也不会对环境造成污染;![]() 、
、![]() ;
;
(3)将![]() 加热脱水可制备无水
加热脱水可制备无水![]() ,故答案为:加热脱水;
,故答案为:加热脱水;
(4)滤渣2为Al(OH)3和Fe(OH)3,若用甲方案,所得产物中将含较多的![]() 杂质,故甲方案不可行,丙方案中有硫酸钠生成,所以原子利用率不如乙方案,故答案为:甲;所得产品中含有较多
杂质,故甲方案不可行,丙方案中有硫酸钠生成,所以原子利用率不如乙方案,故答案为:甲;所得产品中含有较多![]() 杂质;乙;
杂质;乙;
(5)空气中有水蒸气,样品加热后不应置于空气中冷却,应置于干燥器中冷却,样品“加热、冷却、称量”需进行多次直至恒重,故答案为:样品加热后不应置于空气中冷却,应置于干燥器中冷却;样品“加热、冷却、称量”需进行多次直至恒重。

 阅读快车系列答案
阅读快车系列答案