题目内容
【题目】常温下,将0.1molL﹣1氢氧化钠溶液与0.06molL﹣1硫酸溶液等体积混合,该混合溶液的pH等于( )
A.1.7
B.2.0
C.12.0
D.12.4
【答案】B
【解析】解:设溶液的体积都是1L,则氢氧化钠的物质的量为1L×0.1molL﹣1=0.1mol,
硫酸的物质的量为1L×0.06molL﹣1=0.06mol,H+的物质的量为0.06mol×2=0.12mol,
则当酸碱发生中和时H+和OH﹣的物质的量分别为0.12mol和0.1mol,
则硫酸过量,过量的H+的物质的量为0.12mol﹣0.1mol=0.02mol,
则反应后溶液中H+的物质的量浓度为c(H+)= ![]() =0.01 molL﹣1 ,
=0.01 molL﹣1 ,
pH=﹣lg10﹣2=2.0,故选:B.

练习册系列答案
相关题目
【题目】某化学小组通过查阅资料,设计了如图所示的方法以含镍废催化剂为原料来制备NiSO47H2O.已知某化工厂的含镍废催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%). 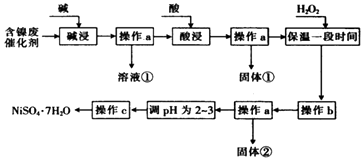
部分阳离子以氢氧化物形式沉淀时的pH如表:
沉淀物 | 开始沉淀时的pH | 完全沉淀时的pH |
Al(OH)3 | 3.8 | 5.2 |
Fe(OH)3 | 2.7 | 3.2 |
Fe(OH)2 | 7.6 | 9.7 |
Ai(OH)2 | 7.1 | 9.2 |
(1)“碱浸”过程中发生反应的离子方程式是
(2)“酸浸”时所加入的酸是(填化学式).
(3)加入H2O2时发生反应的离子方程式为
(4)操作b为调节溶液的pH,你认为pH的调控范围是 .