题目内容
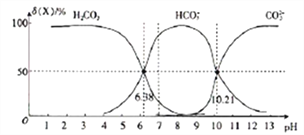
【题目】25℃时,向H2CO3溶液中滴入NaOH溶液,溶液中H2CO3、HCO3-及CO32-的物质的量分数δ(X)随溶液pH的变化如图所示[δ(X)=[![]() ]×100%]。
]×100%]。
下列说法错误的是( )
A. H2CO3的一级电离平衡常数的对数值lgK1(H2CO3)=-6.38
B. pH=7时,c(HCO3-)>c(H2CO3)> c(CO32-)
C. pH=13时,c(Na+)+c(H+)=c(OH-)+2c(CO32-)
D. 25℃时,反应CO32-+H2O![]() HCO3-+OH-的平衡常数对数值1gK=-3.79
HCO3-+OH-的平衡常数对数值1gK=-3.79
【答案】C
【解析】根据图像可知,pH=6.38时,c(H+)=10-6.38mol/L,c(H2CO3)= c(HCO3-) ,所以,H2CO3的一级电离平衡常数的对数值lgK1(H2CO3)=-6.38,A项正确;由图中信息可知,pH=7时,c(HCO3-)>c(H2CO3)> c(CO32-),B项正确;pH=13时,由电荷守恒可知,c(Na+)十c(H+)=c(OH-)+ c(HCO3-)+2c(CO32-),C项错误;由图可知,pH=10.21时,c(H+)=10-10.21mol/L,c(CO32-)= c(HCO3-) ,所以K2(H2CO3)= 10-10.21,因此,25℃时,反应CO32-+H2O![]() HCO3-+OH-的平衡常数Kh=
HCO3-+OH-的平衡常数Kh=![]() =10-3.79,其对数值1gK=-3.79,D项正确。
=10-3.79,其对数值1gK=-3.79,D项正确。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目



