题目内容
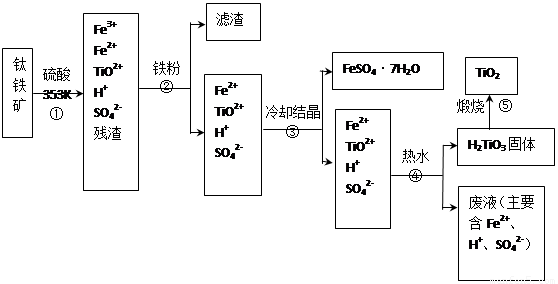
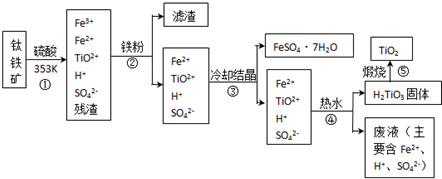
工业上,以钛铁矿为原料制备二氧化钛的工艺流程如图所示.钛铁矿主要成分为钛酸亚铁(FeTiO3),其中一部分铁元素在风化过程中会转化为+3价.
已知:TiOSO4遇水会水解.
(1)写出相应的离子方程式:
步骤①中,钛元素从钛铁矿中溶入溶液时发生的反应为:
步骤②中,用铁粉将Fe3+转化为Fe2+的反应的为
(2)步骤③中,实现混合物的分离是利用物质的
a.熔沸点差异 b.溶解性差异 c.氧化性、还原性差异
(3)步骤②、③、④中,均需用到的分离操作是
(4)可以利用生产过程中的废液与软锰矿(主要成分为MnO2)反应生产硫酸锰(MnSO4,易溶于水),则反应的离子方程式为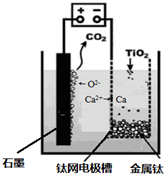
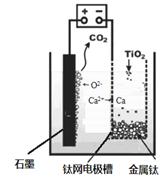
(5)研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,利用如图所示装置获得金属钙,并以钙为还原剂,还原二氧化钛制备金属钛.写出阳极所发生反应的电极反应式:

已知:TiOSO4遇水会水解.
(1)写出相应的离子方程式:
步骤①中,钛元素从钛铁矿中溶入溶液时发生的反应为:
FeTiO3+4H+=Fe2++TiO2++2H2O
FeTiO3+4H+=Fe2++TiO2++2H2O
;步骤②中,用铁粉将Fe3+转化为Fe2+的反应的为
2Fe3++Fe=3Fe2+
2Fe3++Fe=3Fe2+
.(2)步骤③中,实现混合物的分离是利用物质的
b
b
(填字母序号).a.熔沸点差异 b.溶解性差异 c.氧化性、还原性差异
(3)步骤②、③、④中,均需用到的分离操作是
过滤
过滤
(填操作名称);步骤④中使用热水的目的是促使TiO2+水解平衡正向移动
促使TiO2+水解平衡正向移动
.(4)可以利用生产过程中的废液与软锰矿(主要成分为MnO2)反应生产硫酸锰(MnSO4,易溶于水),则反应的离子方程式为
MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O
MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O
.
(5)研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,利用如图所示装置获得金属钙,并以钙为还原剂,还原二氧化钛制备金属钛.写出阳极所发生反应的电极反应式:
2O2--4e-=O2↑,或C+2O2--4e-=CO2↑
2O2--4e-=O2↑,或C+2O2--4e-=CO2↑
.分析:(1)转化关系中生成的离子分析判断发生反应的物质和离子及其生成的离子,结合电荷守恒,原子守恒配平写出离子方程式;
(2)根据物质溶解度本题分析析出晶体的条件应用;
(3)依据操作过程中形成的物质溶解性和分离目的分析回答;
(4)依据二氧化锰的氧化性氧化亚铁离子分析氧化还原反应生成二价锰的化合物,结合电荷守恒和原子守恒写出;
(5)依据图示生成物质的分析,阳极生成二氧化碳,阴极析出钙,结合电解池中阳极发生氧化反应,阴极发生还原反应,写出电极反应;
(2)根据物质溶解度本题分析析出晶体的条件应用;
(3)依据操作过程中形成的物质溶解性和分离目的分析回答;
(4)依据二氧化锰的氧化性氧化亚铁离子分析氧化还原反应生成二价锰的化合物,结合电荷守恒和原子守恒写出;
(5)依据图示生成物质的分析,阳极生成二氧化碳,阴极析出钙,结合电解池中阳极发生氧化反应,阴极发生还原反应,写出电极反应;
解答:解:(1)依据转化关系中的生成两种判断,钛铁矿溶于酸生成亚铁离子和TiO2+,反应的离子方程式结合电荷守恒原子守恒配平写出为:FeTiO3+4H+=Fe2++TiO2++2H2O;步骤②中,用铁粉将Fe3+转化为Fe2+的反应的离子方程式为:2Fe3++Fe=3Fe2+
故答案为:FeTiO3+4H+=Fe2++TiO2++2H2O;2Fe3++Fe=3Fe2+
(2)步骤③冷却结晶得到硫酸亚铁晶体,利用的是物质溶解度的不同,通过冷却热饱和溶液得到,故答案为:b;
(3)②③④步骤的操作过程中都得到沉淀或晶体,所以需要过滤得到固体和溶液,④中使用热水的目的是促进TiO2+水解生成H2TiO3,分离出固体加热得到TiO2;
故答案为:过滤;促使TiO2+水解平衡正向移动;
(4)利用生产过程中的废液与软锰矿(主要成分为MnO2)反应生产硫酸锰(MnSO4,易溶于水),利用二氧化锰的氧化性氧化亚铁离子为三价铁离子,反应的离子方程式为:MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;
故答案为:MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;
(5)用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,阳极发生氧化反应,阴极析出钙金属发生还原反应,阳极图示产物可可知,阳极生成二氧化碳气体,是电解质中的氧离子失电子生成氧气,氧气和阳极石墨反应生成的二氧化碳,所以电极反应为:2O2--4e-=O2↑,或C+2O2--4e-=CO2↑;
故答案为:2O2--4e-=O2↑,或C+2O2--4e-=CO2↑;
故答案为:FeTiO3+4H+=Fe2++TiO2++2H2O;2Fe3++Fe=3Fe2+
(2)步骤③冷却结晶得到硫酸亚铁晶体,利用的是物质溶解度的不同,通过冷却热饱和溶液得到,故答案为:b;
(3)②③④步骤的操作过程中都得到沉淀或晶体,所以需要过滤得到固体和溶液,④中使用热水的目的是促进TiO2+水解生成H2TiO3,分离出固体加热得到TiO2;
故答案为:过滤;促使TiO2+水解平衡正向移动;
(4)利用生产过程中的废液与软锰矿(主要成分为MnO2)反应生产硫酸锰(MnSO4,易溶于水),利用二氧化锰的氧化性氧化亚铁离子为三价铁离子,反应的离子方程式为:MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;
故答案为:MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;
(5)用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,阳极发生氧化反应,阴极析出钙金属发生还原反应,阳极图示产物可可知,阳极生成二氧化碳气体,是电解质中的氧离子失电子生成氧气,氧气和阳极石墨反应生成的二氧化碳,所以电极反应为:2O2--4e-=O2↑,或C+2O2--4e-=CO2↑;
故答案为:2O2--4e-=O2↑,或C+2O2--4e-=CO2↑;
点评:本题考查了物质分离的流程分析判断,物质性质的应用,离子性质的应用,分离操作的方法,氧化还原反应的离子方程式的书写方法,电解池原理的应用,电极反应的书写原则.

练习册系列答案
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案
相关题目