题目内容
在元素周期表短周期元素中,A、B、C、M是单质。M是一种日常常用金属,有关转化如图:

请回答:
(1)元素M在元素周期表的位置: 周期, 主族。
(2)①写出B与C在加热条件下反应的化学方程式:
② C与D反应的化学方程式为:
③写出M与F的水溶液反应的离子方程式:
(3)将1mol E和1mol碳酸氢钠混合放在密闭容器中加热,加热至300℃经充分反应后排出气体。
写出:
①容器内残留的固体物质名称及其物质的量 ;
②在容器中发生的化学反应的化学方程式: ;
(15分)
(1)三,ⅢA(各1分)
(2)2Na+O2
Na2O2(2分)
2Na+2H2O=2NaOH+H2↑(2分)
(3)2Al+2OH—+2H2O
2AlO2—+3H2↑(2分)
(4)碳酸钠(1分),1mol(1分),氢氧化钠(1分) 1mol(1分)
2NaHCO3 Na2CO3+H2O↑+CO2↑
2Na2O2+2CO2
Na2CO3+H2O↑+CO2↑
2Na2O2+2CO2 2Na2CO3+O2
2Na2O2+2H2O===4NaOH+O2 (每个1分)
【解析】一定要注意本题所涉及的元素均为短周期元素,M是一种日常常用金属,可知M为铝。铝和单质B可反应,根据B的化合物及性质,可猜测B为氧气;进而可知D、E分别是由A、C和氧气反应得到,均为氧化物且可反应产生氧气,可推测出D、E应该是Na2O2、CO2或Na2O2、H2O;再由D、E的产物F可与铝反应可知D、E应该是Na2O2、H2O反应生成了F:NaOH。由F(NaOH)与M(铝)反应生成了A与H,可知A为氢气。
到此为止,可知A、B、C分别为氢气、氧气、钠单质。
(3)将1mol Na2O2和1mol碳酸氢钠混合放在密闭容器中加热,发生下列反应:
2NaHCO3 Na2CO3+H2O↑+CO2↑
Na2CO3+H2O↑+CO2↑
2Na2O2+2CO2
2Na2CO3+O2
2Na2O2+2H2O===4NaOH+O2 (每个1分)
NaHCO3分解产生的两个气体恰好与Na2O2反应生成相应的产物。

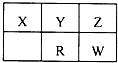 短周期元素X、Y、Z、R和W在元素周期表的位置如图所示,其中W元素族序数等于周期序数的2倍.则下列说法正确的是( )
短周期元素X、Y、Z、R和W在元素周期表的位置如图所示,其中W元素族序数等于周期序数的2倍.则下列说法正确的是( )| A、原子半径从小到大:X<Y<R<W | B、Z、W元素与X均可以形成AB2型化合物 | C、X有多种同素异形体,而Z不存在同素异形体 | D、Z的氢化物稳定性大于W的氢化物稳定性,是因为Z的氢化物分子间存在氢键 |
五种元短周期元素有关数据如表。其中的X是表示元素原子在分子内吸收电子能力的大小,X越大,原子吸引电子的能力越强,其最大值为4.0,最小值是0.7。试回答下列问题:
| 元素编号 | A | B | C | D | E |
| X | 3.5 | 3.0 | X3 | 1.5 | 1.5 |
| 主要化合价 | -2 | +7 | +6 | +3 | +2 |
(1)X3的值应该为( )
A.3.6 B.3.1 C.2.5 D.1.4
(2)E元素在元素周期表中的位置是 ,B元素单质的电子式为 。
(3)A元素的原子中有 个未成对电子。A、B、C元素形成的单质中,结构微粒间作用力最强的是 (写物质名称)。
(4)用一个化学反应可以证明B和C非金属性的强弱,写出该反应的化学方程式:
。
用一个化学反应也可以证明D元素和与D元素同周期且原子半径最大的元素(非零族)的金属性的强弱,写出该反应的离子方程式:
。
(14分)X、Y、Z、W、Q是原子序数依次增大的短周期主族元素,相关信息如下表:
|
元 素 |
相关信息 |
|
X |
X原子核外最外层电子数是次外层的2倍 |
|
Y |
Y的气态氢化物的水溶液显弱碱性 |
|
Z |
Z是地壳中含量最多的金属元素 |
|
W |
常温常压下,W的单质是淡黄色固体 |
|
Q |
…… |
根据上述信息回答下列问题:
(1)元素Q在元素周期表中的位置______________________________.
(2)Y的最简单气态氢化物甲的水溶液可与H2O2发生反应,其产物不污染环境,化学方程式为______________________________________.(用元素符号表示,下同)
(3)X和氢元素组成的化合物分子有6个原子,其结构式为 .
(4)已知:X(s)+O2(g) =XO2(g) △H = -393.5kJ·mol-1
2X(s)+O2(g) =2XO(g) △H = -221.0kJ·mol-1
则XO的燃烧热的热化学方程式__________________________________________________.
(5)元素Y与氢元素形成的五核阳离子乙,向含乙和Z的阳离子的混合溶液中加入固体Na2O2, 加入Na2O2的物质的量与产生沉淀有如图所示关系:

写出有关反应离子方程式:(每段只用一个离子方程式表示)
o—a段
a—b段 .
 A、B、C、D、E、F六种元素分属三个短周期,且原子序数依次增大,A的原子在周期表中半 径最小,A、D伺主族,可形成离子化合物DA;C、F同主族,可形成FC2,FC3两种分子B,D,E 三者的最高价氧化物对应的水化物两两之间均可反应生成可溶性盐和水,所得盐中均含C元 素.请填写下列空白:
A、B、C、D、E、F六种元素分属三个短周期,且原子序数依次增大,A的原子在周期表中半 径最小,A、D伺主族,可形成离子化合物DA;C、F同主族,可形成FC2,FC3两种分子B,D,E 三者的最高价氧化物对应的水化物两两之间均可反应生成可溶性盐和水,所得盐中均含C元 素.请填写下列空白: