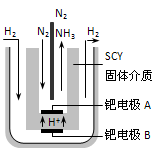
��Ŀ����
�ϳɰ�����Ҫ�Ļ�ѧ��ҵ��Ϊ���о��ϳɰ��ķ�Ӧԭ������һ�ܱ������ڳ���1 mol N2��2 mol H2����һ�������£�ʹ֮�������·�Ӧ��N2+3H2  2NH3��
2NH3��
����ά���¶Ȳ��䣬���ܱ��������ݻ��̶�Ϊ1 L��
L��
(1) ���˷�Ӧ����2 min�ﵽƽ��״̬ʱ����÷�Ӧ�������NH3�����ʵ���Ϊ0.2 moL����H2��2 min�ڵ�ƽ����Ӧ����Ϊ__________________��
(2)�����ʼʱ����������ڼ���0.5 moL N2��Ҫʹ��Ӧ�������������������ʵ���������������ƽ��ʱ����ȫ��ͬ���������H2 _______mo l��NH3 _______mol��
l��NH3 _______mol��
(3)�����ʼʱ����N2��H2��NH3�����ʵ����ֱ�Ϊa mol ��b mol ��c mol ��Ҫʹ��Ӧ�ﵽƽ��״̬ʱ����Ӧ�������������������ʵ�����������(1)ƽ��ʱ��ȫ��ͬ����a��b��cӦ�����һ�������ǣ�a��b�ֱ��ú�c�ķ���ʽ��ʾ�� ��
�����¶�ά�ֲ��䣬��ϵѹǿά�������ͬ���ܱ��������ݻ���1 L�淴Ӧ���ж��ı䡣
(4)��ʼʱ����1 mol N2��2 mol H2������һ��ʱ�䣬������������������ʵ����������ٷ����仯ʱ����NH3�����ʵ���Ϊ__________��ѡ��һ����ţ�
(��)����0.2 mol (��)����0.2 mol
(��)С��0.2 mol (��)���ܴ��ڡ����ڻ�С��0.2mol
�������жϵ�������__________________________________________��
(1)0.15 mol��L-1��min-1 (2��)
(2) 0.5 1.0 (4��)
(3)a +c="1 " b+ c="2" (3��)
(4)�� �¶Ȳ���ʱ���淴Ӧ�Ľ��У����������С����ϵѹǿ��ƽ��(1)ʱ����ƽ��������Ӧ�����ƶ� (4��)
����

���ǵ����Ϻ����ḻ��һ��Ԫ�أ������仯�����ڹ� ũҵ������������������Ҫ���ã�
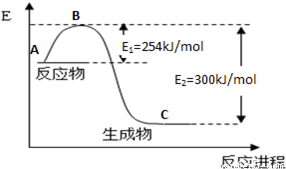
��1����ͼ��N2(g)��H2(g)��Ӧ����1mol NH3(g)�����������仯ʾ��ͼ����д��N2��H2��Ӧ���Ȼ�ѧ����ʽ�� ��
��2������֪�������ݣ�
|
��ѧ�� |
H��H |
N��N |
|
����/kJ��mol��1 |
435 |
943 |
�Ը��ݱ��м�ͼ�����ݼ���N-H�ļ��� kJ��mol��1��
��3���ϳɰ���Ӧͨ��������ý��������ʹ������ý��E1��E2�ı仯�ǣ�E1 ��E2______��
��H (���������С���������䡱)��
��4����NH3����ԭNOX���������������������Ⱦ������
4NH3(g)+3O2(g)�� 2N2(g)+6H2O(g) ����H1��akJ��mol-1
N2(g)+O2(g)��2NO(g)�� ��H2��bkJ/mol
��1mol NH3��ԭNO��N2����÷�Ӧ�����еķ�Ӧ�ȡ�H3�� kJ/mol���ú�a��b��ʽ�ӱ�ʾ����
 M+D+E����E��M=A+F+B
M+D+E����E��M=A+F+B
 M+D+E����E��M=A+F+B
M+D+E����E��M=A+F+B
 2NH3(g)����H= -92.4 kJ/mol��
2NH3(g)����H= -92.4 kJ/mol��