��Ŀ����
̼��Ƴ����������Ħ������ijͬѧ�����һ���Ʊ�̼��Ƶķ�����������ͼ���£�������ʯ��ʯ��������SiO2��
�ش��������⣺
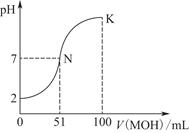
��1���������110��ʯ��ʯ�õ�����66�֡���״�������ɶ�����̼�����Ϊ______________L��ʯ��ʯ��̼��Ƶ���������Ϊ______________%��
��2������ڢٲ���Ӧ��ȫ���У���ڢڲ���Ӧ���˺�õ��IJ����������ijɷ�Ϊ________________________��
��3���ڢ۲���Ӧһ�㲻����ͨ��CO2����Ҫԭ����______________________��
��Ӧ�����ӷ���ʽΪ_____________________________________��
��4��CaCO3��һ���������ʣ�25��ʱ��Ksp��2.8��10��9���ֽ��������CaCl2��Һ��Na2CO3��Һ��ϣ���Na2CO3��Һ��Ũ��Ϊ2.0��10��4 mol/L�������ɳ�������CaCl2��Һ�����ʵ���Ũ����С��______________��
��5��ijѧ����ʯ��ʯΪԭ�ϣ��������һ���Ʊ�̼��Ƶ�ʵ�鷽����������ͼ���£�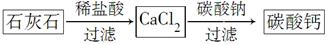
��ǰһ������Ƚϣ��÷������ŵ���_________________________________��
��1��2.24��107��90.9
��2��CaSiO3
��3��ͨ��CO2���������ƣ�ʹ���ɵ�̼�����CO2�������������ܽ�
CaCO3��CO2��H2O=Ca2����2HCO3-
��4��5.6��10��5 mol/L
��5������Ҫ���ȣ���������������ȼ�ϵ���Ⱦ
����

A��B��C��D�ֱ���HNO3��Ba(NO3)2��NH4Cl��NaOH������Һ�е�һ�֡���������һһ���𣬼ס��ҡ����ֱ�������·�������ش��й����⣺
��1����ͬѧ������Xһ���Լ��������������ʣ�����������X��Һ�ֱ���뵽������Һ�У�������֣�C��Һ��Ϊ�ػ�ɫ��B��Һ���а�ɫ����������D��Һ������ʹʪ��ĺ�ɫʯ����ֽ���������������ͬʱ������ɫ���������ձ�Ϊ���ɫ��
B�Ļ�ѧʽ��________��D�ĵ���ʽ��________��X�Ļ�ѧʽ��________��A��Һ��ˮ�ĵ���̶�________(����ڡ�����С�ڡ����ڡ�)C��Һ��ˮ�ĵ���̶ȡ�
��2����ͬѧ��������������������������ʣ�д���ܼ����NH4Cl��Һ���漰���������ӷ���ʽ��Ba2����SO42-=BaSO4����________________________��
��3����ͬѧ��MgSO4����������������Һ�������ɵİ�ɫ����Mg(OH)2�зֱ����HNO3��NH4Cl��Һʱ�����ֳ������ܽ⡣���������ֽ��ͣ�ͬʱ�ṩ�±����ݣ�
A��NH4Cl��Һ��ʹMg(OH)2�ܽ⣬��Ҫ��NH4+ˮ�����H����Ե�ʡ�
B��NH4Cl��Һ��ʹMg(OH)2�ܽ⣬��Ҫ��NH4+���OH����Ե�ʡ�
| 0.01 mol��L��1 �������Һ | HF | CH3COOH | HCN | NH3��H2O |
| ����H����� ��OH����Ũ��/mol��L��1 | 8.00��10��4 | 1.32��10��4 | 1.00��10��4 | 1.33��10��4 |
��Ҫ֤��A��B��һ�ֽ�����ȷ�����������ɵ�Mg(OH)2�����м���һ�����ʣ��������ʵĻ�ѧʽΪ__________________��
������25��ʱ�������ܵ���ʵ��ܽ�ȣ�
| ���ݵ���� | Mg(OH)2 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| �ܽ��/g | 9��10-4 | 1.7��10-6 | 1.5��10-4 | 3.0��10-9 |
������������ᴿ�У����������ܵ���ʵ��ܽ�ƽ��ԭ����ȥijЩ���ӡ����磺
��Ϊ�˳�ȥ�Ȼ���е�����Fe3�����Ƚ����������ˮ������һ�������Լ���Ӧ�����˺�ᾧ��
��Ϊ�˳�ȥ�Ȼ�þ�����е�����Fe3�����Ƚ����������ˮ������������Mg(OH)2����ַ�Ӧ�����˺�ᾧ��
��Ϊ�˳�ȥ����ͭ�����е�����Fe2�����Ƚ����������ˮ������һ������H2O2����Fe2��������Fe3����������Һ��pH��4�����˺�ᾧ��
��ش��������⣺
(1)�������ֳ��ӷ������ܹ��ﵽ�ܺõ�Ч����Fe2����Fe3������ת��Ϊ ����ȥ��
(2)���м�����Լ�Ӧ��ѡ�� Ϊ�ˡ�
(3)���г�ȥFe3�����������ܷ�Ӧ�����ӷ���ʽΪ ��
(4)�����뷽������ص������У���ȷ���� (����ĸ)��
A��H2O2����ɫ�������������������в��������ʡ���������Ⱦ
B����Fe2������ΪFe3������Ҫԭ����Fe(OH)2������Fe(OH)3�������ѹ���
C��������ҺpH��4��ѡ����Լ���������ͭ���ʽ̼��ͭ
D��Cu2+���Դ���������pH��4����Һ��
E����pH��4����Һ��Fe3��һ�����ܴ�������
ij�о�С�����Mg(OH)2�����ܽ�����ɵ�ʵ��̽����
��2֧ʢ��1 mL 1 mol��L-1��MgCl2��Һ�и�����10��2 mol��L-1 NaOH���Ƶõ���Mg(OH)2������Ȼ��ֱ������м��벻ͬ�Լ�����¼ʵ���������±���
| ʵ����� | �����Լ� | ʵ������ |
| �� | 4 mL 2 mol��L-1 HCl ��Һ | �����ܽ� |
| �� | 4 mL 2 mol��L-1 NH4Cl ��Һ | �����ܽ� |
��1���ӳ����ܽ�ƽ��ĽǶȽ���ʵ���ķ�Ӧ���� ��
��2�����ʵ���������NH4Cl��Һ�����ԣ�pHԼΪ4.5���������ӷ���ʽ�����������Ե�ԭ�� ��
��3����ͬѧ��ΪӦ����һ��ʵ�飺��ͬ����Mg(OH)2�����м�4 mL����ˮ���۲쵽�������ܽ⡣��ʵ���Ŀ���� ��
��4��ͬѧ�Dz²�ʵ����г����ܽ��ԭ�������֣�һ��NH4Cl��Һ�����ԣ���Һ�е�H+���Խ��OH- ������ʹ�����ܽ⣻���� ��
��5����ͬѧ��������ʵ�飺��4 mL 2 mol��L-1 NH4Cl��Һ�еμ�2��Ũ��ˮ���õ�pHԼΪ8�Ļ����Һ����ͬ����Mg(OH)2�����м���û����Һ���۲�����
��ʵ����֤����4���еĵڶ��ֲ²��dz����ģ���ͬѧ��õ�ʵ�������� ��
����ͬѧ�������ƻ����Һ�������� ��