题目内容
10.现有部分元素的性质与原子(或分子)结构如表:| 元素编号 | 元素性质与原子(或分子)结构 | |
| T | 最外层电子数是次外层电子数的3倍 | |
| X | 常温下单质为双原子分子,分子中含有3对共用电子对 | |
| Y | M层比K层少1个电子 | |
| Z | 第三周期元素的简单离子中半径最小 | |
| W | W带两个负电荷的阴离子与Ar具有相同电子层结构 | |
 .
.(2)元素Y与元素Z相比,金属性较强的是Na(用元素符号表示),下列表述中能证明这一事实的是cd(填序号).
a.Y单质的熔点比Z单质低
b.Y的化合价比Z低
c.Y单质与水反应比Z单质剧烈
d.Y最高价氧化物的水化物的碱性比Z强
(3)T、X、Y、Z中有两种元素能形成既有离子键又有非极性共价键的化合物,写出该化合物的电子式:
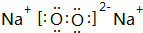 .
.(4)元素T和氢元素以原子个数比1:1化合形成化合物Q,元素X与氢元素以原子个数比1:2化合形成常用作火箭燃料的化合物W,Q与W发生氧化还原反应,生成X单质和T的另一种氢化物,写出该反应的化学方程式:N2H4+2H2O2═N2↑+4H2O.
(5)T、W(+4价)、Y形成的正盐溶液中含有溶质0.20mol,另一溶液是200mL盐酸,不管将前者滴加入后者,还是将后者滴加入前者,都有气体产生,但最终生成的气体体积不同,则盐酸的浓度合理的是B
A.2.0mol/L B.1.5mol/L C.0.18mol/L D.0.24mol/L.
分析 T元素原子最外层电子数是次外层电子数的3倍,原子只能有2个电子层,最外层电子数为6,则T为O元素;
常温下X的单质为双原子分子,分子中含有3对共用电子对,则X为N元素;
Y元素原子M层比K层少1个电子,则M层的电子数为1,Y为Na;
第三周期元素的简单离子中Z的半径最小,则Z为Al,
W带两个负电荷的阴离子与Ar具有相同电子层结构,则W的质子数为18-2=16,然后结合元素化合物知识来解答.
解答 解:T元素原子最外层电子数是次外层电子数的3倍,原子只能有2个电子层,最外层电子数为6,则T为O元素;
常温下X的单质为双原子分子,分子中含有3对共用电子对,则X为N元素;
Y元素原子M层比K层少1个电子,则M层的电子数为1,Y为Na;
第三周期元素的简单离子中Z的半径最小,则Z为Al,
W带两个负电荷的阴离子与Ar具有相同电子层结构,则W的质子数为18-2=16,
(1)T为O,原子结构示意图为 ,故答案为:
,故答案为: ;
;
(2)Na、Al同周期,随原子序数增大,金属性减弱,故Na的金属性较强
a.单质的熔点属于物理性质,不能比较金属性强弱,故a错误;
b.Y的化合价比Z低,金属性强弱与失去电子难易有关,与失去电子数目多少无关,即与化合价高低无关,故b错误;
c.Na单质与水反应比Al单质剧烈,说明Na金属性更强,故c正确;
d.Na最高价氧化物的水化物的碱性比Al强,说明钠的金属性更强,故d正确;
故答案为:Na;cd;
(3)O、N、Na、Al中有两种元素能形成既有离子键又有共价键的化合物,该化合物为Na2O2,其电子式为 ,
,
故答案为: ;
;
(4)O元素和氢元素可形成一种18电子的化合物Q为H2O2,N元素与氢元素也能按原子个数比为1:2形成一种18电子化合物W为N2H4,H2O2与N2H4发生氧化还原反应,生成氮气与水,该反应的化学方程式为N2H4+2H2O2═N2↑+4H2O,
故答案为:N2H4+2H2O2═N2↑+4H2O;
(5)当亚硫酸钠滴入盐酸中时发生SO32-+2H+═H2O+SO2↑,
当盐酸滴入亚硫酸钠溶液时,反应顺序为SO32-+H+═HSO3-、HSO3-+H+═H2O+SO2↑,则HCl的物质的量应大于Na2SO3的物质的量,又因为最终生成的气体体积不同,
则HSO3-+H+=H2O+SO2不能全部完成,即HCl的物质的量比Na2SO3的物质的量的二倍少,
亚硫酸钠的物质的量为0.2mol,
则HCl的物质的量应介于0.2mol~0.4mol之间,
盐酸溶液的体积为200mL=0.2L,
即盐酸的浓度应该是大于1mol/L,小于2mol/L.
故答案为:B.
点评 本题考查位置、结构与性质的关系及应用,为高频考点,把握元素的位置、元素的推断及元素化合物知识为解答的关键,(5)为解答的难点,注意反应的先后顺序,题目难度中等.

| 实验步骤 | 1.将一小块金属钠放入滴有酚酞溶液的冷水中; 2.将一小段用砂纸打磨后的镁带放入试管中,加入少量水,加热至水沸腾,冷却后,向试管中滴加酚酞溶液; 3.将一小段镁带投入稀盐酸中; 4.将一小片铝投入稀盐酸中. |
| 实验现象 | A.剧烈反应,迅速生成大量的气体 B.浮在水面上,熔成小球,不断游动,小球渐小最终消失,溶液变红 C.反应不剧烈,产生无色气体 D.有气体产生,溶液变成红色 |
| 实验步骤 | 1 | 2 | 3 | 4 |
| 实验现象 | B | D | A | C |
| A. | 质子数:c>d | B. | 原子半径:X<W | ||
| C. | 氢化物的稳定性:H2Y>HZ | D. | 离子的还原性:Y2->Z- |
| 选项 | 含杂质的物质 | 试剂 | 除杂方法 |
| A | C2H4(SO2) | NaOH溶液 | 洗气 |
| B | C6H6(Br2) | Fe粉 | 蒸馏 |
| C | C6H5NO2(HNO3) | NaOH溶液 | 分液 |
| D | C2H6(C2H4) | 酸性KMnO4溶液 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |
①168O ②O2③188O ④O3 ⑤O4 ⑥O2- ⑦O22-.
| A. | ①③⑥ | B. | ②④⑤ | C. | ①②⑦ | D. | ④⑤⑦ |
| A. | NH4+、Na+、Cl-、OH- | B. | Fe2+、H+、NO3-、SO42- | ||
| C. | NH4+、K+、HCO3-、OH- | D. | Fe3+、NH4+、NO3-、SO42- |
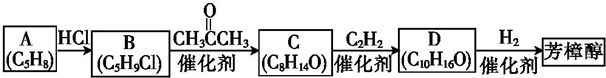
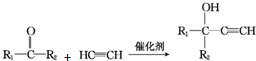 (R1、R2均为烃基)
(R1、R2均为烃基) ,该反应类型为加成反应.
,该反应类型为加成反应. .
.

 +NaOH$→_{△}^{醇}$
+NaOH$→_{△}^{醇}$ +NaCl+H2O
+NaCl+H2O
 .
.

 .
.