题目内容
【题目】金属A是地壳中含量最多的金属.金属A可以产生如图变化(部分参与反应的物质和反应条件省略): 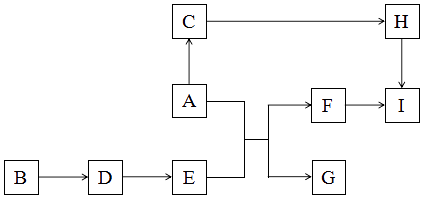
已知:
金属A暴露在空气中时会迅速生成C;D是一种淡黄色的化合物;G是气体;H是硝酸盐.
(1)请写出下列物质的化学式:D: F: I:
(2)请写出生成气体G的离子方程式:H与氨水反应生成I的离子方程式:
(3)当把金属A薄片在空气中加热时,观察到的现象是金属A熔化而不滴落,原因是 .
(4)某同学设计了用金属A和浓HNO3在常温下反应直接得到盐H的方案.该同学的方案是否能达到实验目的?(是或否)原因是 .
【答案】
(1)Na2O2; NaAlO2; Al(OH)3
(2)2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑; Al3++3NH3?H2O=Al(OH)3↓+3NH4+
(3)氧化铝的熔点远高于铝,包裹住了熔化的铝使其不滴落
(4)否;常温下铝遇浓硝酸钝化
【解析】解:金属A是地壳中含量最多的金属,则A为金属Al;Al在空气中迅速被氧化成氧化铝,则C为Al2O3;H是硝酸盐,则H为Al(NO3)3;D是一种淡黄色的化合物,则D为Na2O2;E能够与金属铝反应生成气体G,则E为NaOH,G为H2,F为NaAlO2;Al(NO3)3、NaAlO2都能够转化成I,则I为Al(OH)3,(1)根据分析可知,D为Na2O2、F为 NaAlO2、I为Al(OH)3,
所以答案是:Na2O2;NaAlO2;Al(OH)3;(2)气体G为氢气,Al与氢氧化钠溶液反应生成偏铝酸钠和氢气,反应的离子方程式为:2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑;
H与氨水反应生成I的离子方程式为:Al3++3NH3H2O=Al(OH)3↓+3NH4+,
所以答案是:2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑;Al3++3NH3H2O=Al(OH)3↓+3NH4+;(3)由于氧化铝的熔点远高于铝,加热铝片后生成的氧化铝包裹住了熔化的铝使其不滴落,
所以答案是:氧化铝的熔点远高于铝,包裹住了熔化的铝使其不滴落;(4)常温下金属铝与浓硝酸发生钝化现象,阻止了反应的继续进行,则常温下不能用铝与浓硝酸制取硝酸铝,
所以答案是:否;常温下铝遇浓硝酸钝化.


