题目内容
20.某无色透明溶液,跟金属铝反应放出H2,试判断下列离子:Mg2+、Ba2+、Cu2+、H+、Ag+、SO${\;}_{4}^{2-}$、SO${\;}_{3}^{2-}$、OH-、HCO${\;}_{3}^{-}$、NO${\;}_{3}^{-}$,何种离子能大量存在于此溶液中.(1)当生成Al3+时,可能存在Mg2+、H+、SO42-.
(2)当生成[Al(OH)4]-时,可能存在Ba2+、OH-、NO3-.
分析 液无色,则一定不存在有色的Cu2+离子,与铝反应生成氢气,则溶液中存在大量氢离子或氢氧根离子,
(1)当生成Al3+时,说明溶液呈酸性,因在含HNO3的溶液中放入Al不生成H2,则一定不存在NO3-离子,与H+离子反应的离子不能大量共存;
(2)当生成AlO2-时,说明溶液呈碱性,溶液中存在大量的OH-离子,与OH-离子反应的离子不能大量共存,以此解答该题.
解答 解:该溶液能跟金属铝反应放出H2,为非氧化性酸或强碱溶液,
(1)当生成Al3+时,溶液显酸性,与氢离子反应的不能存在SO32-、HCO3-、OH -,且Al、NO3-发生氧化还原反应不能生成氢气,Cu2+为蓝色,由电荷守恒可知阴离子一定存在SO42-,则不能存在Ba2+,可以可可能存在的离子为:Mg2+、H+、SO42-,
故答案为:Mg2+、H+、SO42-;
(2)当生成AlO2-时,溶液显碱性,与氢氧根离子反应的Mg2+、Cu2+、H+、HCO3-不能存在,由电荷守恒可知一定存在Ba2+,则与Ba2+反应的SO42-、SO32-不能存在,则溶液中可存在的离子为:Ba2+、OH-、NO3-,
故答案为:Ba2+、OH-、NO3-.
点评 本题考查离子的共存、常见离子的检验方法,为高频考点,题目难度中等,明确离子反应发生条件及常见离子的性质为解答关键,注意(1)中硝酸根离子判断为解答的易错点,试题培养了学生的逻辑推理能力及灵活应用能力.

练习册系列答案
 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案
相关题目
10.下列推断正确的是( )
| A. | SiO2 是酸性氧化物,能与NaOH溶液反应 | |
| B. | Na2O、Na2O2组成元素相同,与 CO2反应产物也相同 | |
| C. | CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 | |
| D. | 通过化学变化可以实现16O与18O间的相互转化 |
11.下列物质能使溴的四氯化碳溶液发生反应褪色的是( )
| A. | 甲烷 | B. | 乙烷 | C. | 乙烯 | D. | 苯 |
8. 元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )
 元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )| A. | 非金属性:Z<T<X | |
| B. | X最高价氧化物的水化物的表达式为H2XO4 | |
| C. | 气态氢化物稳定性:R<T<Q | |
| D. | R与Q的电子数相差26 |
5.下列有机物的系统命名法正确的一组是( )
| A. | 新戊烷C(CH3)4 | B. | 3-乙基-1-丁烯 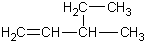 | ||
| C. | 2-甲基-2,4-己二烯  | D. | 2,2,3-三甲基戊烷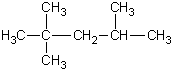 |
12.根据下列有关图象,说法正确的是( )


| A. | 由图Ⅰ知,反应在T1、T3处达到平衡,且该反应的△H<0 | |
| B. | 由图Ⅱ知,各平衡状态在t6时,NH3体积分数最小 | |
| C. | 由图Ⅱ知,t3时采取的措施是降低反应体系温度 | |
| D. | Ⅲ在10L容器、850℃时反应,由图知,到4min时,反应放出5.16kJ的热量 |
9.下列搭配错误的是( )
| A. | 阿伏伽德罗常数----N | B. | 物质的量-----n | ||
| C. | 气体摩尔体积------Vm | D. | 物质的量浓度----CB |
10.下列说法正确的是( )
| A. | 水的离子积常数仅表示一定温度下纯水中H+浓度和OH-浓度的乘积 | |
| B. | 水的离子积常数是固定不变的一个数值 | |
| C. | 判断溶液酸碱性的标准是比较H+浓度和OH-浓度的相对大小 | |
| D. | pH=-1的硫酸溶液不存在 |
 (1)某有机物含碳85.7%、氢14.3%,向80g含溴5%的溴水中通入该有机物,溴水恰好完全褪色,此时液体总重81.4g.
(1)某有机物含碳85.7%、氢14.3%,向80g含溴5%的溴水中通入该有机物,溴水恰好完全褪色,此时液体总重81.4g. .任选其中一种写出其生成高聚物的化学方程式
.任选其中一种写出其生成高聚物的化学方程式 (或
(或
 +3HNO3
+3HNO3
 +3H2O.
+3H2O.