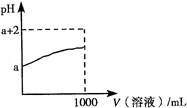
题目内容
下列叙述正确的是
- A.周期表中碱金属元素从上到下,其单质的还原性逐渐增强,熔沸点逐渐升高
- B.分别在Na2CO3和NaHCO3两种物质的溶液中,加入少量BaCl2溶液,能鉴别这两种物质
- C.向品红溶液中同时通入相同物质的量的SO2和Cl2,溶液褪色。
- D.向某溶液中加入硝酸钡溶液和稀硝酸,有白色沉淀产生。证明原溶液中一定含有SO42-
B
试题分析:碱金属元素从上到下,金属性增强,单质还原性增强,但碱金属单质是金属晶体,从上到下,金属键减弱,单质熔点降低,A错误;碳酸钠与氯化钡生成碳酸钡沉淀,碳酸氢钠与氯化钡不反应,B正确;向品红溶液中通入等物质的量的二氧化硫和氯气,发生反应:SO2+Cl2+2H2O=H2SO4+2HCl,硫酸和盐酸无漂白性,品红不褪色,C错误;硝酸具有强氧化性,若原溶液中存在SO32-或HSO3-,向溶液中加入硝酸钡溶液和稀硝酸也会产生白色沉淀,D错误。
考点:元素周期律 物质的鉴别 无机物的性质 SO42-的检验
点评:检验SO42-的方法:向溶液中先加盐酸,无现象,再加氯化钡溶液产生白色沉淀。不可以根据“加盐酸酸化的氯化钡溶液,产生白色沉淀”证明含SO42-,因也可能形成氯化银沉淀;也不可能用硝酸酸化,因硝酸有强氧化性。
试题分析:碱金属元素从上到下,金属性增强,单质还原性增强,但碱金属单质是金属晶体,从上到下,金属键减弱,单质熔点降低,A错误;碳酸钠与氯化钡生成碳酸钡沉淀,碳酸氢钠与氯化钡不反应,B正确;向品红溶液中通入等物质的量的二氧化硫和氯气,发生反应:SO2+Cl2+2H2O=H2SO4+2HCl,硫酸和盐酸无漂白性,品红不褪色,C错误;硝酸具有强氧化性,若原溶液中存在SO32-或HSO3-,向溶液中加入硝酸钡溶液和稀硝酸也会产生白色沉淀,D错误。
考点:元素周期律 物质的鉴别 无机物的性质 SO42-的检验
点评:检验SO42-的方法:向溶液中先加盐酸,无现象,再加氯化钡溶液产生白色沉淀。不可以根据“加盐酸酸化的氯化钡溶液,产生白色沉淀”证明含SO42-,因也可能形成氯化银沉淀;也不可能用硝酸酸化,因硝酸有强氧化性。

练习册系列答案
相关题目
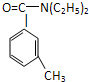 避蚊胺(又名DEET)是一种对人安全、活性高且无抗药性的新型驱蚊剂,其结构简式为:已知:RCOOH
避蚊胺(又名DEET)是一种对人安全、活性高且无抗药性的新型驱蚊剂,其结构简式为:已知:RCOOH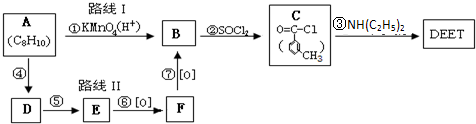
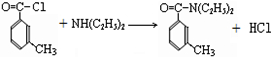
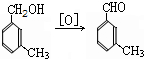
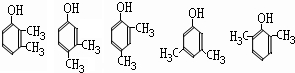 (任写2种)
(任写2种)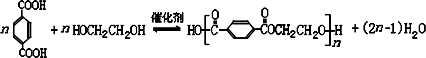
 NH3?H2O+H+
NH3?H2O+H+ (2010?崇文区二模)X、Y、Z、W均为含有10电子的微粒,其中X、Y、Z为分子,W为离子,且X与Z分子中含有的共用电子对数之比为3:4.
(2010?崇文区二模)X、Y、Z、W均为含有10电子的微粒,其中X、Y、Z为分子,W为离子,且X与Z分子中含有的共用电子对数之比为3:4.