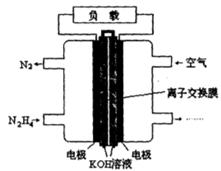
��Ŀ����
��1����3Cu��8HNO3��3Cu(NO3)2��2NO����4H2O��Ӧ�У�_______����������_______�ǻ�ԭ����_______Ԫ�ر�������_______Ԫ�ر���ԭ��______���������_______�ǻ�ԭ�������ԭ��HNO3��μӷ�Ӧ��HNO3���ʵ���֮����___ __����˫���ű���÷�Ӧ����ת�Ƶķ������Ŀ��
��2��˫���ű����ӦKClO3+ 6HCl��KCl + 3 Cl2�� + 3H2O����ת�Ƶķ������Ŀ����2�֣�
��11�֣���1��HNO3��Cu ��Cu��N��Cu(NO3)2��NO ��1:4��ÿ��1�֣���7�֣� ����2�֣�
����2�֣�
��2�� ��2�֣�
��2�֣�
���������������1����3Cu��8HNO3��3Cu(NO3)2��2NO����4H2O��Ӧ��ͭԪ�صĻ��ϼ۴�0�����ߵ���2�ۣ�ʧȥ2�����ӣ�������������ԭ��������ͭ���������������NԪ�صĻ��ϼ۴ӣ�5�۽��͵���2�ۣ��õ�3�����ӣ�����ԭ���������������������ǻ�ԭ������ݷ�Ӧ�ķ���ʽ��֪����ԭ��HNO3��μӷ�Ӧ��HNO3���ʵ���֮����2:8��1:4�����ݵ��ӵ�ʧ�غ��֪�������ת�Ƶķ������Ŀ�ɱ�ʾΪ ��
��
��2���ڷ�ӦKClO3+ 6HCl��KCl + 3 Cl2�� + 3H2O���Ȼ�������Ԫ�صĻ��ϼ۴ӣ�1�����ߵ�0�ۣ�ʧȥ1�����ӡ����������Ԫ�صĻ��ϼ۴ӣ�5�۽���0�ۣ��õ�5�����ӣ�����ݵ��ӵ�ʧ�غ��֪�������ת�Ƶķ������Ŀ�ɱ�ʾΪ ��
��
���㣺����������ԭ��Ӧ���й��жϡ���ʾ

 ��У����ϵ�д�
��У����ϵ�д��ס�����ͬѧ�о�Na2SO3��Һ��FeCl3��Һ��Ӧ�������
| ���� | ���� | ���� |
| I | ��2 mL 1 mol��L-1FeCl3��Һ�м���һ������Na2SO3��Һ | ��Һ���ػ�ɫ��Ϊ���ɫ�� ���������̼�����ζ�������ݳ� |
��1�������£�FeCl3��Һ��pH_______7�����������������=������
��2���������ɫ������ԭ��
�� ��ͬѧ��Ϊ����I����Һ�ʺ��ɫ����Ϊ������Fe(OH)3���û�ѧƽ���ƶ�ԭ��������Һ�ʺ��ɫ��ԭ��________��
�� ��ͬѧ��Ϊ�����Ƿ�����������ԭ��Ӧ����ɲ���ƽ�䷴Ӧ�����ӷ���ʽ��
Fe3+ +
 SO32- +
SO32- + =
= F e2+ +
F e2+ + +
+

��ͬѧ�������ϵ�֪��
| 1��Fe2+��SO32-��Ӧ����ī��ɫ����״����FeSO3�� 2��ī��ɫ��FeSO3���ɫ��FeCl3��Һ��Ϻ���Һ�ʺ��ɫ�� |
��3����ͬѧΪ��ȷ����Һ�ʺ��ɫ��ԭ����������Fe(OH)3����Ʋ����������ʵ�飺
| ���� | ���� | ���� |
| II | �ü�������䲽��I�еĺ��ɫ��Һ | ���֡������ЧӦ�� |
��4��Ϊ��һ��ȷ��Na2SO3��Һ��FeCl3��Һ��Ӧ���������ͬѧ��Ʋ����������ʵ�飺
| ���� | ���� | ���� |
| III | ��1 mol?L-1��FeCl3��Һ��ͨ��һ������SO2 | ��Һ�ɻ�ɫ��Ϊ���ɫ |
| IV | �ü�������䲽��III�еĺ��ɫ��Һ | û�г��֡������ЧӦ�� |
�� �����鲽��III�к��ɫ��Һ����Fe2+������Fe2+ѡ�õ��Լ���_________������ĸ����
a��K3[Fe(CN)6] ��Һ b��KSCN��Һ c��KMnO4��Һ
�� ��֪H2SO3�����ᣬ���ϵ��뷽��ʽ˵������III�г��ֺ��ɫ��ԭ�� ��
��5�����ۣ�������ʵ���֪���ס�����ͬѧ���ֹ۵����ȷ��
��1���ü���������һ�����۵����ⷽ�����йص��Ȼ�ѧ����ʽ����:
CH4(g)+1/2O2(g)  CO(g)+2H2(g)����H= ��36kJ/mol������ ��
CO(g)+2H2(g)����H= ��36kJ/mol������ ��
CH4(g)+H2O(g)  CO(g)+3H2(g)����H= +216kJ/mol����������
CO(g)+3H2(g)����H= +216kJ/mol����������
������˵����ȷ���� ____
| A��2H2O(l)=2H2(g)+O2(g) ��H=+504kJ/mol |
| B������Ӧ���Ц�(CH4)��=��(CO)��ʱ�������÷�Ӧ��ƽ��״̬ |
| C��������������ʱ��������ϵѹǿ����Ӧ�٢��м����ת���ʾ����� |
| D��Ϊά�ֺ㶨�¶ȣ�������������ʧ����ij��Ӧ����ͬʱ������Ӧ�����ʱ�����ļ� |
��ij�¶��£���100L��Ӧ���г�������ˮ���������ʵ����ֱ�Ϊ100mol��300molʱ���ٶ�ֻ������ӦCH4(g)+H2O(g)
 CO(g)+3H2(g)���������ת����Ϊ0.5ʱ����ʱƽ�ⳣ��Ϊ _______
CO(g)+3H2(g)���������ת����Ϊ0.5ʱ����ʱƽ�ⳣ��Ϊ _______��2������Һ����NaNO3��NaNO2��NaOH��ɵģ��ڼ��������£�ͨ��������Ӧʹ����������һ�����ܵ�Fe3O4��
3Fe+NaNO2+5NaOH
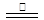 3Na2FeO2+H2O+NH3�����������٣�
3Na2FeO2+H2O+NH3�����������٣�8Fe+3NaNO3+5NaOH+2H2O
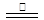 4Na2Fe2O4+3NH3�������ڣ�
4Na2Fe2O4+3NH3�������ڣ��Լ������������������������벹���������Ӧ�ķ���ʽ����ƽ�� __________________