题目内容
【题目】甲醇(CH3OH)是一种重要的化工原料,广泛应用于化工生产,也可以直接用做燃料。
已知:CH3OH(1)+ O2(g) =CO(g) + 2H2O(g) ;△Ha = -443.64 kJ·mol-1
2CO (g) + O2(g) = 2CO2(g) ;△Hb =-566.0 kJ·mol-1
(1)试写出CH3OH(1)在氧气中完全燃烧生成CO2和H2O(g)的热化学方程式: 。
(2) CH3OH和H2的燃烧热分别为△H=-725.5kJ/mol、△H=-285.8kJ/mol,写出工业上以CO2和H2为原料合成CH3OH的热化学方程式____________________。
(3)科研人员新近开发出一种由甲醇和氧气以强碱做电解质溶液的新型手机电池,可使手机连续使用一个月才充一次电,据此回答下列问题: 甲醇在 极反应;电极反应式为 。
(4)利用电池可实现电能向化学能转化。某同学设计了一种电解法制取Fe(OH)2的实验装置(如下图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色。下列说法中正确的是 (填序号)
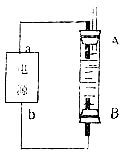
A.电源中的a一定为正极,b一定为负极 B.可以用NaCl溶液作为电解液
C.A、B两端都必须用铁作电极 D.阴极发生的反应是:2H+ + 2e-→H2↑
【答案】(1)2CH3OH(1) +3O2(g) = 2CO2(g) + 4H2O(g);△H =-1453.28kJ·mol-1
(2)CO2(g)+3H2(g) ![]() CH3OH(l)+H2O(l) △H=-131.9kJ/mol
CH3OH(l)+H2O(l) △H=-131.9kJ/mol
(3)负;CH3OH + 8OH--6e-= CO32-+ 6H2O
(4)A、B、D。
【解析】
试题分析:(1)根据题意可知①CH3OH(1) + O2(g) =CO(g) + 2H2O(g) ; △Ha = -443.64 kJ·mol-1;②2CO (g) + O2(g) = 2CO2(g) ; △Hb =-566.0 kJ·mol-1。①×2+②可得CH3OH(1)在氧气中完全燃烧生成CO2和H2O(g)的热化学方程式2CH3OH(1) +3O2(g) = 2CO2(g) + 4H2O(g);△H =-1453.28kJ·mol-1;
(2)CH3OH和H2的燃烧热分别为△H = -725.5kJ/mol、△H = -285.8kJ/mol,可得热化学方程式:①2CH3OH(1) +3O2(g) = 2CO2(g) + 4H2O(g);△H = - 1453.28 kJ·mol-1; ② 2H2(g) + O2(g) = 2H2O(l) △H = -571.6 kJ·mol-1;② × 3/2 - ① × 1/2,整理可得工业上以CO2和H2为原料合成CH3OH的热化学方程式是CO2(g)+3H2(g) ![]() CH3OH(l) + H2O(l) △H = -131.9kJ/mol;
CH3OH(l) + H2O(l) △H = -131.9kJ/mol;
(3)由甲醇和氧气以强碱做电解质溶液的新型手机电池,可使手机连续使用一个月才充一次电,该电池是原电池,通入燃料甲醇的电极是负极,由于是碱性环境,所以甲醇被氧化产生CO32-,电极反应式为CH3OH + 8OH--6e-= CO32-+ 6H2O;
(4)某同学设计了一种电解法制取Fe(OH)2的实验装置(如下图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色。说明Fe作阳极,发生氧化反应,H+在阴极发生还原反应,变为H2逸出,使溶液显碱性,Fe2+与OH-结合形成的Fe(OH)2由于在H2的环境,所以Fe(OH)2不会被氧气氧化,使我们可以较长时间观察到沉淀的白色。A.因为生成的氢气将装置中原有氧气带出,且氢气的密度小于水,所以氢气从B端阴极析出,A电极则是铁做阳极失去电子生成亚铁离子,所以“a”为正极,“b”为负极,正确;B.因为阳极是铁,活泼电极作阳极时,阳极材料铁失电子生成亚铁离子,阴极上氢离子放电,生成氢气,所以能生成氢氧化亚铁白色沉淀,则电解液选用NaCl溶液不影响实验,正确;C.阳极应该用铁电极,阴极可以是铁也可以是其他惰性电极,错误;D.阳极应该用铁电极,阴极可以是铁也可以是其他惰性电极,阴极上水得电子生成氢气和氢氧根离子,氢气能防止氢氧化亚铁被氧化而导致实验失败,所以电极反应式为:2H+ + 2e-→H2↑,正确。

 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案