题目内容
5.一定量的氢气在氯气中燃烧,所得混合物用100mL 3.00mol/L的NaOH溶液(密度为1.12g/mL)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.0500mol.(假设反应前后溶液体积不变)(1)燃烧前Cl2在标准状况下的体积是多少升?
(2)所得溶液中Cl- 的物质的量浓度?
(3)所用氯气和参加反应的氢气的物质的量之比?
分析 (1)由于最终溶液中的溶质只有NaCl、NaClO,则n(Cl2)=$\frac{1}{2}$[n(Cl-)+n(ClO-)]=$\frac{1}{2}$n(Na+),进而计算氯气在标况下体积;
(2)由于最终溶液中的溶质只有NaCl、NaClO,则n(Na+)=n(Cl-)+n(ClO-),据此计算出氯离子物质的量,进而计算浓度;
(3)由题意可知氯气过量,反应后所得混合物为HCl和Cl2,涉及反应有HCl+NaOH=NaCl+H2O、Cl2+2NaOH=NaCl+NaClO+H2O,据反应可知,燃烧后剩余Cl2为n(Cl2)余=n(NaClO),与H2反应的Cl2为n(Cl2)-nn(Cl2)余,据此计算解答.
解答 解:(1)由于最终溶液中的溶质只有NaCl、NaClO,则n(Cl2)=$\frac{1}{2}$[n(Cl-)+n(ClO-)]=$\frac{1}{2}$n(Na+)=$\frac{1}{2}$×0.1L×3.00mol/L=0.15mol,标况下体积为:0.15mol×22.4L/mol=3.36L;
答:燃烧前Cl2在标准状况下的体积是3.36升;
(2)由于最终溶液中的溶质只有NaCl、NaClO,则n(Na+)=n(Cl-)+n(ClO-),所以,n(Cl-)=0.1 L×3.00 mol/L-0.0500 mol=0.250 mol,c(Cl-)=$\frac{0.250mol}{0.1L}$=2.5mol/L;
答:所得溶液中Cl- 的物质的量浓度2.5mol/L;
(3)由题意可知氯气过量,反应后所得混合物为HCl和Cl2,
涉及反应有HCl+NaOH=NaCl+H2O、Cl2+2NaOH=NaCl+NaClO+H2O,
据反应可知,燃烧后剩余Cl2为n(Cl2)余=n(NaClO)=0.05 mol,
与H2反应的Cl2为0.15mol-0.05mol=0.1mol=n(H2),
则所用氯气和参加反应的氢气的物质的量之比n(Cl2):n(H2)=0.15mol:0.1mol=3:2;
答:所用氯气和参加反应的氢气的物质的量之比n(Cl2):n(H2)=0.15mol:0.1mol=3:2.
点评 本题考查化学方程式计算、混合物计算,侧重于学生计算能力和分析能力的考查,注意判断反应的程度以及相关方程式的书写,注意利用守恒思想解答.

| X | ||
| Y | Z | R |
| W |
| A. | 五种元素的原子最外层电子数一定大于2 | |
| B. | 五种元素一定都是非金属元素 | |
| C. | Z的氧化物与X单质在任何条件下都不会发生置换反应 | |
| D. | R的最外层电子数一定为5 |
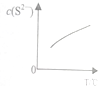 硫粉不溶于水、微溶于酒精,却易溶于Na2S溶液,发生如下反应:(x-1)S(s)+S2-(aq)?Sx2-(aq)(x≤6),达到平衡后,C(S2-)随温度T的变化如图所示.下列有关说法正确的是( )
硫粉不溶于水、微溶于酒精,却易溶于Na2S溶液,发生如下反应:(x-1)S(s)+S2-(aq)?Sx2-(aq)(x≤6),达到平衡后,C(S2-)随温度T的变化如图所示.下列有关说法正确的是( )| A. | 反应(x-1)S(s)+S2-(aq)?Sx2-(aq)的△H>0 | |
| B. | 该反应的平衡常数随温度的升高而减小 | |
| C. | 其他条件不变时,向平衡后的溶液中再加入硫粉,可使溶液中c(Sx2-)增大 | |
| D. | 依此原理,常温下Cl2在饱和NaCl溶液中的溶解度也比在水中的大 |
| A. | CH4 | B. | H3O+ | C. | NH2- | D. | F- |
| A. | 由乙炔制氯乙烯;甲烷与氯气在光照条件下反应 | |
| B. | 溴乙烷和氢氧化钠乙醇溶液共热;乙醇制得乙烯 | |
| C. | 乙烯使溴的四氯化碳溶液褪色;乙烯使酸性高锰酸钾溶液褪色 | |
| D. | 溴乙烷和氢氧化钠溶液共热;乙烯和氢气反应 |
| A. | $\frac{a}{A+m}$(A-N+m) | B. | $\frac{a}{A}$(A-N) | C. | $\frac{a}{A+m}$(A-N) | D. | $\frac{a}{A}$(A-N+m) |
| A. | 六氟化氙(XeF6) | B. | 次氯酸(HClO) | C. | 二氧化碳(CO2) | D. | 三氟化硼(BF3) |
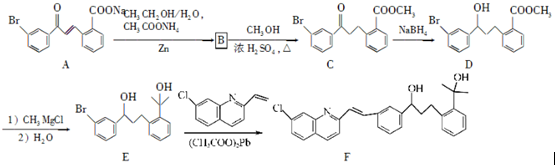 请回答下列问题:
请回答下列问题: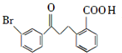 .
.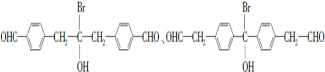 .
. 为原料制备
为原料制备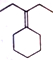 的合成路线流程图(乙醚溶剂及无机试剂任用)
的合成路线流程图(乙醚溶剂及无机试剂任用)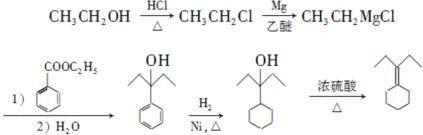 ;
;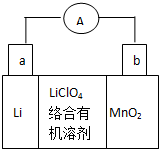 锂锰电池的体积小,性能优良,是常用的一次电池.该电池反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+ 通过电解质迁移入MnO2晶格中,
锂锰电池的体积小,性能优良,是常用的一次电池.该电池反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+ 通过电解质迁移入MnO2晶格中,