题目内容
【题目】某学习小组通过下列装置探究MnO2与FeCl3·6H2O能否反应产生Cl2。
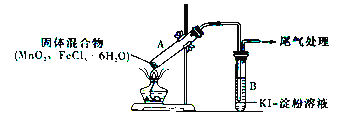
实验操作和现象如下表所示:
实验编号 | 操作 | 现象 |
实验1 | 按上图所示装置加热MnO2与FeCl3·6H2O混合物 | ①试管A中部分固体溶解,上方出现白雾 ②稍后,产生黄色气体,管壁附着黄色液滴 ③试管B中溶液变蓝 |
实验2 | 把试管A中的混合物换为FeCl3·6H2O,试管B中溶液换为KSCN溶液,加热 | 试管A中部分固体溶解,产生白雾和黄色气体;试管B中KSCN溶液变红 |
请回答下列问题:
(1)实验1和实验2 产生白雾的原因是_____________________________。
(2)实验2说明黄色气体中含有_____________(填化学式)。
(3)为进一步确认黄色气体中是否含有Cl2,该学习小组对实验1提出两种改进方案:
方案1:在试管A、B间增加盛有某种试剂的洗气瓶C,结果试管B 中溶液仍变为蓝色。
方案2:将试管B中KI-淀粉溶液替换为NaBr溶液,结果试管B 中溶液呈橙红色,且未检出Fe2+。则方案1中洗气瓶C 中盛放的试剂是_________;方案2 中检验Fe2+的试剂的名称是______,选择NaBr溶液后试管B中发生的主要反应的离子方程式为______________________________________。
(4)实验1充分加热后,若将试管A中产物分离得到Fe2O3 和MnCl2,则试管A 中产生Cl2 的化学方程式为__________________________________________。其尾气处理的方法是_______________________。
(5)该学习小组认为实验1中溶液变蓝,可能还有另外一种原因是__________________。请你设计实验方案验证此猜想_______________________________________________。
【答案】 FeCl3·6H2O受热失去结晶水,FeCl3水解生成HCl气体,HCl和H2O结合形成盐酸小液滴 FeCl3 饱和NaCl溶液 铁氰化钾溶液 2Br-+Cl2==Br2+2C1- MnO2+2FeCl3·6H2O![]() Fe2O3+MnCl2+ Cl2↑+2HC1↑+11H2O 将尾气通入到氢氧化钠溶液中(其他合理答案均可) 实验未先赶出空气,其中的O2在此条件下可能氧化I- 向一试管中加入与实验1中等量的KI-淀粉溶液,再滴入几滴稀盐酸,在空气中放置,观察相同时间后溶液是否变蓝(其他合理答案均可)
Fe2O3+MnCl2+ Cl2↑+2HC1↑+11H2O 将尾气通入到氢氧化钠溶液中(其他合理答案均可) 实验未先赶出空气,其中的O2在此条件下可能氧化I- 向一试管中加入与实验1中等量的KI-淀粉溶液,再滴入几滴稀盐酸,在空气中放置,观察相同时间后溶液是否变蓝(其他合理答案均可)
【解析】(1)FeCl3是强酸弱碱盐,水解产生氢氧化铁和HCl,加热时HCl及水蒸气挥发,在空气中相遇,形成盐酸的小液滴,故出现白雾;答案为:FeCl3·6H2O受热失去结晶水,FeCl3水解生成HCl气体,HCl和H2O结合形成盐酸小液滴。
(2)根据实验现象,试管A中产生白雾和黄色气体,试管B中KSCN溶液变红,说明在溶液和黄色气体中均含有FeCl3;答案为:FeCl3
(3)①方案1:FeCl3能氧化碘离子,氧气在酸性条件下能氧化碘离子,所以需除去Cl2中的FeCl3和O2,所以C中盛放的试剂是用来除FeCl3和O2,而不除Cl2的饱和NaCl溶液;方案2中检验Fe2+的试剂是铁氰化钾溶液,遇到亚铁离子生成蓝色沉淀;选择NaBr溶液后试管B中发生的离子方程式为:2Br-+Cl2=Br2+2C1- ;答案为:饱和NaCl溶液 ,铁氰化钾溶液 ,2Br-+Cl2=Br2+2C1-
(4)综上所述可知氯化铁晶体与MnO2混合加热,发生反应产生Fe2O3和MnCl2、氯气和水,反应的化学方程式是:MnO2+2FeCl3·6H2O![]() Fe2O3+MnCl2+ Cl2↑+2HC1↑+11H2O。Cl2和HC1易溶于氢氧化钠溶液中,尾气处理的方法是:将尾气通入到氢氧化钠溶液中;答案为:MnO2+2FeCl3·6H2O
Fe2O3+MnCl2+ Cl2↑+2HC1↑+11H2O。Cl2和HC1易溶于氢氧化钠溶液中,尾气处理的方法是:将尾气通入到氢氧化钠溶液中;答案为:MnO2+2FeCl3·6H2O![]() Fe2O3+MnCl2+ Cl2↑+2HC1↑+11H2O ;将尾气通入到氢氧化钠溶液中.
Fe2O3+MnCl2+ Cl2↑+2HC1↑+11H2O ;将尾气通入到氢氧化钠溶液中.
(5)实验1中溶液变蓝,可能还有另外一种原因是:在做实验时未先赶出空气,导致其中的O2在此条件下可能氧化I;可设计下述实验方案验证此猜想:向一试管中加入与实验1中等量的KI-淀粉溶液,再滴入几滴稀盐酸,在空气中放置,观察相同时间后溶液是否变蓝,若一段时间后溶液变蓝则推测成立;答案为:实验未先赶出空气,其中的O2在此条件下可能氧化I- ;向一试管中加入与实验1中等量的KI-淀粉溶液,再滴入几滴稀盐酸,在空气中放置,观察相同时间后溶液是否变蓝。

 新思维寒假作业系列答案
新思维寒假作业系列答案【题目】工业上利用氯碱工业中的固体废物盐泥(主要成分为Mg(OH)2、CaCO3、BaSO4,除此之外还有NaCl、Al(OH)3、Fe(OH)3、Mn(OH)2等。)与废稀硫酸反应制备七水硫酸镁,产率高,既处理了三废,又有经济效益。其工艺流程如下:
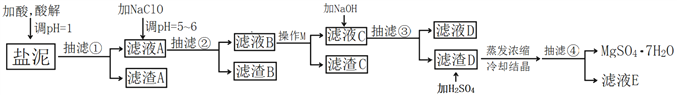
已知:
i)部分阳离子以氢氧化物形式完全沉淀时溶液的pH
沉淀物 | Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
pH值(完全沉淀) | 10.02 | 8.96 | 3.20 | 4.70 | 11.12 |
ii)两种盐的溶解度图(单位为g/100g水)

根据以上流程图并参考表格pH数据和溶解度图,请回答下列问题。
(1)酸解时,加入的酸为____________,在酸解过程中,想加快酸解速率,请提出两种可行的措施____________、____________。
(2)加入的NaClO可与Mn2+反应产生MnO2沉淀,该反应的离子方程式是____________。
(3)本工艺流程多次用到抽滤操作,其优点在于____________,四次抽滤时:抽滤①所得滤渣A的成分为____________、CaSO4;抽滤②所得滤渣B的成分为MnO2、____________、____________;抽滤③所得滤液C中主要杂质阳离子的检验方法是____________;抽滤④将产品抽干。
(4)依据溶解度曲线,操作M应采取的方法是适当浓缩,____________。
(5)每制备1吨MgSO4·7H2O,需要消耗盐泥2吨。若生产过程中的转化率为70%,则盐泥中镁(以氢氧化镁计)的质量分数约为____________。




