题目内容
下列有关叙述中,正确的是( )
分析:A.反应条件与反应的吸热、放热无关;
B.Ba(OH)2?8H2O晶体与NH4Cl晶体混合,为吸热反应;
C.2CO+O2═2CO2为燃烧反应,属于放热反应;
D.标注物质的状态,1molCaCO3固体完全分解会吸收178.5kJ的热量,其对应的△H=+178.5kJ/mol.
B.Ba(OH)2?8H2O晶体与NH4Cl晶体混合,为吸热反应;
C.2CO+O2═2CO2为燃烧反应,属于放热反应;
D.标注物质的状态,1molCaCO3固体完全分解会吸收178.5kJ的热量,其对应的△H=+178.5kJ/mol.
解答:解:A.反应条件与反应的吸热、放热无关,则需要加热才能发生的反应不一定是吸热反应,也可能为放热反应,故A错误;
B.Ba(OH)2?8H2O晶体与NH4Cl晶体混合,为吸热反应,不会放出热量,故B错误;
C.2CO+O2═2CO2为燃烧反应,属于放热反应,则反应物的总能量高于生成物的总能量,故C正确;
D.标注物质的状态,1molCaCO3固体完全分解会吸收178.5kJ的热量,其对应的△H=+178.5kJ/mol,则热化学反应方程式为CaCO3(s)═CaO(s)+CO2 (g)△H=+178.5kJ?mol-1,故D错误;
故选C.
B.Ba(OH)2?8H2O晶体与NH4Cl晶体混合,为吸热反应,不会放出热量,故B错误;
C.2CO+O2═2CO2为燃烧反应,属于放热反应,则反应物的总能量高于生成物的总能量,故C正确;
D.标注物质的状态,1molCaCO3固体完全分解会吸收178.5kJ的热量,其对应的△H=+178.5kJ/mol,则热化学反应方程式为CaCO3(s)═CaO(s)+CO2 (g)△H=+178.5kJ?mol-1,故D错误;
故选C.
点评:本题考查化学能与热能的转化,注意反应条件及反应热效应无直接关系,熟悉常见的吸热、放热反应是解答本题的关键,选项D中的热化学方程式应注明状态为易错点,题目难度不大.

练习册系列答案
相关题目
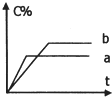 如图表示可逆反应:A(s)+B(g)?nC(g);△H=Q,在不同条件下反应混合物中C的百分含量(C%)和反应过程所需时间(t)的关系曲线.下列有关叙述中一定正确的是( )
如图表示可逆反应:A(s)+B(g)?nC(g);△H=Q,在不同条件下反应混合物中C的百分含量(C%)和反应过程所需时间(t)的关系曲线.下列有关叙述中一定正确的是( )| A、若只使用催化剂,则a表示使用了催化剂,b表示没有使用催化剂 | B、若只控制温度,则a比b的温度高,且△H>0 | C、若只控制压强,则a比b的压强大,且n>2 | D、由图象可以作出判断,反应一定从正反应方向开始 |

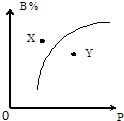 mA(s)+nB(g)?pC(g);△H<0,在室温条件下B的体积分数(B%)与压强(P)的关系如图所示,则下列有关叙述中一定正确的是( )
mA(s)+nB(g)?pC(g);△H<0,在室温条件下B的体积分数(B%)与压强(P)的关系如图所示,则下列有关叙述中一定正确的是( )