题目内容
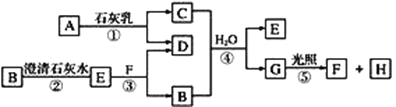
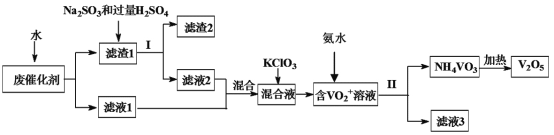
【题目】五氧化二钒广泛用于冶金、化工等行业,用作合金添加剂、生产硫酸或石油精炼用的催化剂等。为回收利用含钒催化剂,研制了一种利用废催化剂(含有V2O5、VOSO4、不溶性硅酸盐)回收V2O5的新工艺流程如图:
已知:(1)部分含钒物质常温下在水中的溶解性如表所示:
物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
(2)VO2++OH-![]() VO3-+H2O
VO3-+H2O
回答下列问题:
(1)用水浸泡废催化剂,为了提高单位时间内废钒的浸出率,在不加试剂情况下,可以采取的措施为__(写一条)。
(2)滤液1和滤液2中钒的存在形式相同,其存在形式为__(填离子符号)。
(3)每生成1mol(VO2)2SO4时转移电子的数目为___。
(4)在滤渣1中加入Na2SO3和过量H2SO4溶液发生反应的离子方程式为___。
(5)结合化学用语,用平衡移动原理解释加入氨水的一种作用为__。
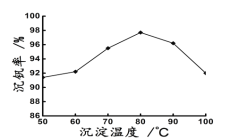
(6)新工艺流程的最后,钒以NH4VO3的形式沉淀出来;如图中横坐标表示反应II的温度,纵坐标表示沉钒率,沉钒率是指NH4VO3沉淀中V元素的质量和废催化剂中V元素的质量之比,也即是钒的回收率。请解释图中温度超过80℃以后,沉钒率下降的可能原因是___。
(7)该工艺流程中可以循环利用的物质为__。
(8)若实验室用的原料中V2O5占6%(原料中的所有钒已换算成V2O5)。取100克该废钒催化剂按工业生产的步骤进行实验。当加入100mL0.1mol/L的KClO3溶液时,溶液中的钒恰好被完全处理,假设与KClO3反应后的操作步骤中钒没有损失,则该实验中钒的回收率是__(保留3位有效数字)。
【答案】粉碎废钒;搅拌;适当升温 VO2+ 2NA或1.204×1024 V2O5+SO32-+4H+=2VO2++SO42-+2H2O 作用1:溶液中存在平衡:VO2++2OH-![]() VO3-+H2O,加入氨水,使OH-浓度增大,该平衡正移,从而使VO2+尽可能都转化为VO3-
VO3-+H2O,加入氨水,使OH-浓度增大,该平衡正移,从而使VO2+尽可能都转化为VO3-
作用2:溶液中存在平衡:NH4VO3(s)![]() NH4+(aq)+VO3-(aq),加入氨水,使NH4+浓度增大,该平衡逆移,从而使NH4VO3尽可能沉淀析出 原因1:温度升高,NH4VO3溶解度增大,沉钒率下降。原因2:温度升高,氨水受热分解逸出溶液,使NH4+浓度下降,沉钒率下降。原因3:温度升高,氨水受热分解逸出溶液,使OH-浓度下降,VO2++2OH-
NH4+(aq)+VO3-(aq),加入氨水,使NH4+浓度增大,该平衡逆移,从而使NH4VO3尽可能沉淀析出 原因1:温度升高,NH4VO3溶解度增大,沉钒率下降。原因2:温度升高,氨水受热分解逸出溶液,使NH4+浓度下降,沉钒率下降。原因3:温度升高,氨水受热分解逸出溶液,使OH-浓度下降,VO2++2OH-![]() VO3-+H2O,该平衡逆移,导致VO3-浓度下降,沉钒率下降。原因4:平衡VO2++2OH-
VO3-+H2O,该平衡逆移,导致VO3-浓度下降,沉钒率下降。原因4:平衡VO2++2OH-![]() VO3-+H2O,正反应可能是放热反应,温度升高,该平衡逆移,导致VO3-浓度下降,沉钒率下降 氨水或NH3和H2O 91.0%
VO3-+H2O,正反应可能是放热反应,温度升高,该平衡逆移,导致VO3-浓度下降,沉钒率下降 氨水或NH3和H2O 91.0%
【解析】
废钒催化剂粉碎、水浸,将溶解性物质溶于水,然后过滤得到滤渣和滤液,根据溶解性表知,滤液中含有VOSO4,滤渣中含有V2O5等不溶性杂质,向滤渣中加入亚硫酸钠和稀硫酸,亚硫酸钠具有还原性,能将V2O5还原为VOSO4,然后过滤得到滤渣和滤液,将两部分滤液混合并加入氯酸钾,氯酸钾具有氧化性,能将VOSO4氧化为(VO2)2SO4,加入氨水,得到难溶性的NH4VO3,焙烧NH4VO3得到V2O5,以此解答该题。
(1)水浸时,为了提高废钒的浸出率,可粉碎废钒、搅拌,适当升高温度,延长浸泡时间;答案为:粉碎废钒;搅拌;适当升温;
(2)废催化剂(含有V2O5、VOSO4、不溶性硅酸盐)用水浸泡,根据题中信息,由于VOSO4是可溶的,过滤时进入虑液1中,又根据题中信息,滤液1和滤液2中钒的存在形式相同,则钒的存在形式为VO2+;答案为VO2+。
(3)由2VOSO4→(VO2)2SO4可以知道,V由+4价到+5价,1摩尔V失1摩尔电子,而(VO2)2SO4中有2摩尔V,故每生成1mol(VO2)2SO4转移2NA个电子;答案为2NA或1.204×1024。
(4)在滤渣1中加入Na2SO3和过量H2SO4溶液发生反应的离子方程式为:V2O5+SO32-+4H+=2VO2++SO42-+2H2O;答案为V2O5+SO32-+4H+=2VO2++SO42-+2H2O。
(5)溶液中存在平衡:VO2++2OH-![]() VO3-+H2O,加入氨水,使OH-浓度增大,该平衡正移,从而使VO2+尽可能都转化为VO3-,另外溶液中存在平衡:NH4VO3(s)
VO3-+H2O,加入氨水,使OH-浓度增大,该平衡正移,从而使VO2+尽可能都转化为VO3-,另外溶液中存在平衡:NH4VO3(s)![]() NH4+(aq)+VO3-(aq),加入氨水,使NH4+浓度增大,该平衡逆移,从而使NH4VO3尽可能沉淀析出;答案为作用1:溶液中存在平衡:VO2++2OH-
NH4+(aq)+VO3-(aq),加入氨水,使NH4+浓度增大,该平衡逆移,从而使NH4VO3尽可能沉淀析出;答案为作用1:溶液中存在平衡:VO2++2OH-![]() VO3-+H2O,加入氨水,使OH-浓度增大,该平衡正移,从而使VO2+尽可能都转化为VO3-,作用2:溶液中存在平衡:NH4VO3(s)
VO3-+H2O,加入氨水,使OH-浓度增大,该平衡正移,从而使VO2+尽可能都转化为VO3-,作用2:溶液中存在平衡:NH4VO3(s)![]() NH4+(aq)+VO3-(aq),加入氨水,使NH4+浓度增大,该平衡逆移,从而使NH4VO3尽可能沉淀析出;
NH4+(aq)+VO3-(aq),加入氨水,使NH4+浓度增大,该平衡逆移,从而使NH4VO3尽可能沉淀析出;
(6)根据已知信息及物质的性质可知温度超过80℃以后,沉钒率下降的可能原因是,原因1:温度升高,NH4VO3溶解度增大,沉钒率下降。原因2:温度升高,氨水受热分解逸出溶液,使NH4+浓度下降,沉钒率下降。原因3:温度升高,氨水受热分解逸出溶液,使OH-浓度下降,VO2++2OH-![]() VO3-+H2O,该平衡逆移,导致VO3-浓度下降,沉钒率下降。原因4:平衡VO2++2OH-
VO3-+H2O,该平衡逆移,导致VO3-浓度下降,沉钒率下降。原因4:平衡VO2++2OH-![]() VO3-+H2O,正反应可能是放热反应,温度升高,该平衡逆移,导致VO3-浓度下降,沉钒率下降。
VO3-+H2O,正反应可能是放热反应,温度升高,该平衡逆移,导致VO3-浓度下降,沉钒率下降。
(7)钒酸铵加热分解2NH4VO3![]() V2O5+2NH3↑+H2O;产物中有V2O5、NH3、H2O,则氨气和水,可循环使用;答案为氨水或NH3和H2O。
V2O5+2NH3↑+H2O;产物中有V2O5、NH3、H2O,则氨气和水,可循环使用;答案为氨水或NH3和H2O。
(8)结合得失电子守恒和原子守恒配平得到加入氯酸钾时发生的反应离子方程式为:6VO2++ClO3-+3H2O=6VO2++Cl-+6H+,根据该离子方程式可得如下关系:3V2O5~6VO2+~ClO3-,100 mL0.1mol/L的KClO3溶液中ClO3-的物质的量为n(ClO3-)=0.1L×0.1mol/L=0.01mol,则对应V2O5的物质的量为0.03mol,质量为:0.03mol×182g/mol=5.46g,所以该实验中钒的回收率为:![]() ×100%=91.0%;答案为91.0%。
×100%=91.0%;答案为91.0%。

【题目】某化学课外活动小组利用废铁屑(含少量硫等元素)为原料制备硫酸亚铁铵晶体[(NH4)2SO4·FeSO4·6H2O],并设计了如图所示的装置(夹持仪器略去)。

称取一定量的表面除去油污的废铁屑于锥形瓶中,加入适量的稀硫酸,在通风橱中置于50~60℃热水浴中加热充分反应。待锥形瓶中溶液冷却至室温后加入氨水,使其反应完全,制得浅绿色悬浊液。
(1)相比通常铁与稀硫酸生成氢气的条件,在实验中选择50~60℃热水浴的原因是___;锥形瓶中溶液冷却至室温后再加入氨水的原因__。
(2)C瓶中KMnO4溶液的作用是__。
(3)若要确保获得浅绿色悬浊液,下列符合实验要求的是__(填字母)。
a.保持铁屑过量
b.控制溶液呈强碱性
c.将稀硫酸改为浓硫酸
(4)莫尔盐是一种重要化学药品,较绿矾稳定,不易被空气氧化,是化学分析中常用的基准物之一。其组成可用(NH4)2SO4FeSO46H2O或(NH4)2Fe(SO4)26H2O表示。一定条件下,(NH4)2Fe(SO4)2发生分解:4(NH4)2Fe(SO4)2=2Fe2O3+5SO2↑+3SO3↑+N2↑+6NH3↑+7H2O下列叙述正确的是__。
a反应生成amolN2时,转移电子的物质的量为6amol
b该反应的还原产物是硫的两种氧化物
c有amol电子转移时,生成SO2的物质的量为0.1amol
d将气体产物用足量BaCl2溶液吸收,只得到一种沉淀物
(5)实验探究:影响溶液中Fe2+稳定性的因素。
配制0.8mol/L的FeSO4溶液(pH=4.5)和0.8mol/L的(NH4)2Fe(SO4)2溶液(pH=4.0),各取2ml上述溶液于两支试管中,刚开始两种溶液都呈浅绿色,分别同时滴加2滴0.01mol/L的KSCN溶液,过了一会儿观察可见(NH4)2Fe(SO4)2溶液仍然为浅绿色透明澄清溶液,FeSO4溶液则出现淡黄色浑浊。
(资料)
沉淀 | Fe(OH)2 | Fe(OH)3 |
开始沉淀pH | 7.6 | 2.7 |
完全沉淀pH | 9.6 | 3.7 |
①请用离子方程式解释FeSO4溶液产生淡黄色浑浊的原因___。
②讨论影响Fe2+稳定性的因素,小组同学提出以下3种假设:
假设1:其它条件相同时,NH4+的存在使(NH4)2Fe(SO4)2溶液中Fe2+稳定性较好。
假设2:其它条件相同时,在一定pH范围内,溶液pH越小Fe2+稳定性越好。
假设3:___。
(6)称取ag所制得的硫酸亚铁铵晶体,用加热煮沸的蒸馏水溶解,配成250mL溶液,取出25mL放入锥形瓶中,用cmol·L-1KMnO4溶液滴定,消耗KMnO4溶液VmL,则硫酸亚铁铵晶体的纯度为___(用含c、V、a的代数式表示)。