题目内容
已知常温下某一元弱酸HA溶液的pH=2,又知0.01mol/L的一元碱BOH溶液中
=1010,将上述两溶液等体积混合,所得溶液中离子浓度关系正确的是( )
| c(OH-) |
| c(H+) |
| A、c(H+)>c(OH-)>c(B+)>c(A-) |
| B、c(B+)>c(A-)>c(H+)>c(OH-) |
| C、c(A-)>c(B+)>c(H+)>c(OH-) |
| D、c(B+)=c(A-)>c(H+)=c(OH-) |
考点:酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:常温下某一元弱酸(HA)溶液的pH值等于2,可知酸的浓度远远大于0.01mol/L;0.01mol/L某一元碱(BOH)溶液里
=1010.依据离子积常数为c(H+)?c(OH-)=10-14;计算得到溶液中氢氧根离子浓度为0.01mol/L,说明碱为强碱,依据弱酸强碱反应后的溶液中物质和离子分析选项.
| (OH-) |
| c(H+) |
解答:
解:常温下某一元弱酸(HA)溶液的pH值等于2,可知酸的浓度远远大于0.01mol/L;0.01mol/L某一元碱(BOH)溶液里
=1010.依据离子积常数为c(H+)?c(OH-)=10-14;计算得到溶液中氢氧根离子浓度为0.01mol/L,说明碱为强碱.
将上述两溶液等体积混合后,碱BOH完全反应,酸HA大量过量,得到强碱弱酸盐BA和弱酸HA的混合溶液,根据电离大于水解,故溶液呈酸性,即有:c(H+)>c(OH-),根据溶液的电中性,可知:c(A-)>c(B+),故离子浓度应为:c(A-)>c(B+)>c(H+)>c(OH-),故选C.
| (OH-) |
| c(H+) |
将上述两溶液等体积混合后,碱BOH完全反应,酸HA大量过量,得到强碱弱酸盐BA和弱酸HA的混合溶液,根据电离大于水解,故溶液呈酸性,即有:c(H+)>c(OH-),根据溶液的电中性,可知:c(A-)>c(B+),故离子浓度应为:c(A-)>c(B+)>c(H+)>c(OH-),故选C.
点评:本题考查了酸碱混合后溶液酸碱性的判断,分析出酸HA是弱酸、碱BOH是强碱是解题的关键.难度不大.

练习册系列答案
 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案
相关题目
 现代无机化学对硫-氮化合物的研究是最为活跃的领域之一.其中如图所示是已合成的最著名的硫-氮化合物的分子结构.下列说法正确的是( )
现代无机化学对硫-氮化合物的研究是最为活跃的领域之一.其中如图所示是已合成的最著名的硫-氮化合物的分子结构.下列说法正确的是( )| A、该物质的分子式为SN |
| B、该物质与化合物S2N2互为同素异形体 |
| C、该物质在固态时形成原子晶体 |
| D、该物质的分子中既有极性键,又有非极性键 |
石头纸(Rich Mineral Paper)也叫石科纸,就是用磨成粉末的碳酸钙为主要原料,加上15%的聚乙烯和5%胶合剂制成的.下列有关“石头纸”的说法错误的是( )
| A、“石头纸”不宜在高温条件下生产 |
| B、“石头纸”能耐强酸与强碱的腐蚀 |
| C、“石头纸”与普通纸相比不易燃烧 |
| D、推广使用“石头纸”能达到保护森林和环保的目的 |
下列实验事实的描述中,正确的是( )
| A、实验室用加热分解氯化铵的方法制氨气 |
| B、向浓硫酸中缓慢加入乙醇和冰醋酸用以制备乙酸乙酯 |
| C、向2mL 10% NaOH溶液中,加入2mL 2mol/L CuSO4溶液,振荡制Cu(OH)2悬浊液,用于检验醛的性质 |
| D、加入Mg(OH)2固体可除去MgCl2溶液中混有的少量FeCl3 |
实验设计是化学实验的重要技能之一.用所给装置(夹持装置省略)完成相关实验,最合理的选项是( )
A、 利用图除去乙烷中的乙烯 |
B、 利用图比较单质S、Cl2的氧化性 |
C、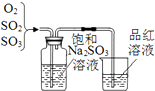 利用图检验硫酸铜晶体受热分解气体中的二氧化硫 |
D、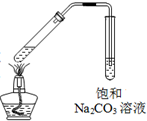 利用图实验室加热浓硫酸、乙醇和乙酸制取乙酸乙酯 |
甲-辛等八种元素在周期表中的相对位置如下表.甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断不正确的是( )
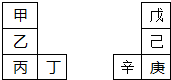

| A、乙的单质在空气中燃烧生成只含离子键的化合物 |
| B、原子半径:辛>己>戊 |
| C、丙与庚的原子核外电子数相差13 |
| D、最高价氧化物的水化物的碱性:丙>乙>甲 |
下列说法不正确的是( )
| A、氯乙烷制乙烯是消去反应 |
| B、苯的同系物能使溴水褪色说明烃基对苯环的性质产生了较大的影响 |
| C、除去电石和水反应产生的乙炔中杂质气体,可用氢氧化钠溶液 |
| D、卤代烃与氢氧化钠的乙醇溶液反应后留下的混合物加硝酸酸化后加硝酸银溶液,可以根据生成沉淀的颜色判断卤素种类 |
下列物质在常温下不会被空气氧化的是( )
①苯酚、②甲苯、③丙三醇、④硫酸亚铁溶液.
①苯酚、②甲苯、③丙三醇、④硫酸亚铁溶液.
| A、①②③ | B、②③ | C、③④ | D、①③ |
 )为基本原料,经过反应得到一系列的芳炔类大环化合物,其结构为:
)为基本原料,经过反应得到一系列的芳炔类大环化合物,其结构为:
 )为起始物质,通过加成、消去反应制得.写出由苯乙烯制取苯乙炔的化学方程式(所需的无机试剂自选)
)为起始物质,通过加成、消去反应制得.写出由苯乙烯制取苯乙炔的化学方程式(所需的无机试剂自选)