��Ŀ����
��CH4��g��+4NO2��g��=4NO��g��+CO2��g��+2H2O��g����H=-574kJ?mol-1
��CH4��g��+4NO��g��=2N2��g��+CO2��g��+2H2O��g����H=-1160kJ?mol-1
����˵������ȷ���ǣ�������
| A�����ñ�״���� 4.48LCH4 ��ԭ NO2����N2��ˮ�������ų�������Ϊ 173.4kJ |
| B���ɷ�Ӧ�ٿ���֪��CH4��g��+4NO2��g��=4NO��g��+CO2��g��+2H2O��l����H��-574 kJ?mol-1 |
| C����Ӧ �٢�ת�Ƶĵ�������ͬ |
| D����Ӧ ���е�4.48LCH4 ��Ӧ��ȫʱת�Ƶĵ�������Ϊ1.60 mol |
| ��+�� |
| 2 |
B����Ӧ����̬ˮ��ΪҺ̬ˮ��Ҫ���ȣ��ʡ�H��-574 kJ?mol-1����B����
C����Ӧ�٢��вμӷ�Ӧ�ļ������ʵ�����ͬ��ת�Ƶĵ�������ͬ����C��ȷ��
D�����ݹ�ϵʽ��CH4��8e-����Ӧ���е�4.48LCH4 ��Ӧ��ȫʱת�Ƶĵ�������Ϊ��0.2mol��8=1.60 mol����D��ȷ��
��ѡB��

2013�����ȫ�����ض�����ж�������ʮ������������ɡ������족����Ҫ��Դ֮һ������β����ȼúβ���ŷų����Ĺ���С������
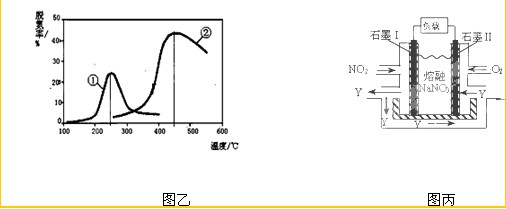
����β����������Ҫԭ��Ϊ��2NO(g)+2CO(g)  2CO2+N2�����ܱ������з����÷�Ӧʱ��c(CO2)���¶�(T)�������ı����(S)��ʱ��(t)�ı仯��������ͼ��ʾ���ݴ��жϣ�
2CO2+N2�����ܱ������з����÷�Ӧʱ��c(CO2)���¶�(T)�������ı����(S)��ʱ��(t)�ı仯��������ͼ��ʾ���ݴ��жϣ�

��1���÷�ӦΪ ��Ӧ(����ȡ������ȡ�������T2�¶��£�0~2s�ڵ�ƽ����Ӧ���ʣ�v(N2)= ����2�����������������һ��ʱ�����������������ѧ��Ӧ���ʡ��������ı����S1>S2���ڴ���ϻ��� c(CO2)��T1��S2�����´ﵽƽ������еı仯���ߡ�
��3��ij���л�������t1���£�����㶨���ܱ������У������崫��������˲�ͬʱ���NO��CO��Ũ�ȣ��������ݼ��±���CO2��N2����ʼŨ��Ϊ0����
|
ʱ��/s |
0 |
1 |
2 |
3 |
4 |
5 |
|
c(NO)/xl0-4 mol L-1 |
10��0 |
4��50 |
2��50 |
1��50 |
1��00 |
1��00 |
|
c(CO)/xl0-3 mol L-1 |
3��60 |
3��05 |
2��85 |
2��75 |
2��70 |
2��70 |
t1��ʱ�÷�Ӧ��ƽ�ⳣ��K= ��ƽ��ʱNO���������Ϊ ��
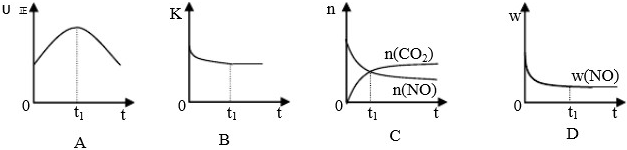
��4�����÷�Ӧ�ھ��ȡ����ݵ��ܱ���ϵ�н��У�����ʾ��ͼ��ȷ����˵����Ӧ�ڽ��е�t1ʱ�̴ﵽƽ��״̬���� (����ţ�������ͼ��v����K��n��m�ֱ��ʾ����Ӧ���ʡ�ƽ�ⳣ�������ʵ�����������

��5��úȼ�ղ���������Ҳ�������������CH4����ԭNOX�������������������Ⱦ��
��֪��CH4(g)+2NO2(g) = N2 (g)+CO2 (g)+2H2O(g) ��H=-867��0 kJ • mol-1
2NO2 (g)  N2O4
(g)
��H=-56��9 kJ • mol-1
N2O4
(g)
��H=-56��9 kJ • mol-1
H2O(g) = H2O(l) ��H=-44��0 kJ • mol-1
д��CH4����ԭN2O4 (g)����N2 (g)��CO2 (g)��H2O(l)���Ȼ�ѧ����ʽ ��

 ��2010?������һģ��һ����̼����������͵�����������Ҫ�Ļ���ԭ�ϣ���Ҳ�Ǵ�������Ҫ��Ⱦ��ۺ���������Ⱦ�ǻ�����ѧ��ǰ����Ҫ�о�����֮һ��
��2010?������һģ��һ����̼����������͵�����������Ҫ�Ļ���ԭ�ϣ���Ҳ�Ǵ�������Ҫ��Ⱦ��ۺ���������Ⱦ�ǻ�����ѧ��ǰ����Ҫ�о�����֮һ��