题目内容
9.工业上用铝土矿(主要成分是Al2O3,还有少量的Fe2O3、SiO2)提取冶炼铝的原料氧化铝.工艺流程如下图:(每步所加试剂均稍过量)
(1)步骤①反应的离子方程式是Al2O3+6H+=2Al3++3H2O、Fe2O3+6H+=2Fe3++3H2O.
(2)原料B的化学式是NaOH,步骤②所得沉淀的化学式是:Fe(OH)3.
(3)步骤③中生成沉淀的化学方程式是:NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3.
(4)如果省去步骤①,即溶解铝土矿是从加入原料B开始,则会对氧化铝的提取有什么影响?若用NaOH溶液溶解铝土矿,则有部分SiO2溶解在NaOH溶液中生成硅酸钠,最后使加热制得的Al2O3混有SiO2杂质.
分析 SiO2和盐酸不反应,Fe2O3和氢氧化钠不反应而氧化铝能反应,向偏铝酸钠中通入过量的二氧化碳可以生成氢氧化铝沉淀,由工艺流程可知步骤③通入的为二氧化碳,生成的沉淀为氢氧化铝,所以滤液②含有AlO2-.步骤②应加入氢氧化钠,除去铁离子,将铝离子转化为AlO2-,所以滤液①中含有Al3+,步骤①应为加入盐酸,除去SiO2.
解答 解:由工艺流程可知步骤③通入的为二氧化碳,生成的沉淀为氢氧化铝,所以滤液②含有AlO2-.步骤②应加入氢氧化钠,所以滤液①中含有Al3+,步骤①应为加入盐酸,除去SiO2.
(1)由上述分析可知,步骤①加入盐酸,除去SiO2,所以原料A为盐酸,氧化铝与酸反应离子方程式为Al2O3+6H+=2Al3++3H2O,氧化铁与盐酸反应离子方程式为Fe2O3+6H+=2Fe3++3H2O,
故答案为:Al2O3+6H+=2Al3++3H2O、Fe2O3+6H+=2Fe3++3H2O;
(2)步骤①加入过量盐酸,滤液①中含有Al3+、Fe3+、H+等,应加入氢氧化钠,除去铁离子,将铝离子转化为AlO2-,反应为 H++OH-=H2O,Fe3++3OH-=Fe(OH)3↓,Al3++4OH-=AlO2-+2H2O.
故答案为:NaOH; Fe(OH)3;
(3)滤液②含有AlO2-,步骤③通入二氧化碳,与AlO2-反应生成的沉淀为氢氧化铝,反应化学方程式为NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3,故答案为:NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3;
(4)若用NaOH溶液溶解铝土矿,则有部分SiO2溶解在NaOH溶液中生成硅酸钠,通入二氧化碳会生成硅酸沉淀,最后使加热制得的Al2O3混有SiO2杂质.
故答案为:若用NaOH溶液溶解铝土矿,则有部分SiO2溶解在NaOH溶液中生成硅酸钠,最后使加热制得的Al2O3混有SiO2杂质.
点评 本题以框图题形式考查铝的化合物的性质,难度中等,清楚冶炼铝工艺流程原理,是对知识迁移的综合运用.

 阅读快车系列答案
阅读快车系列答案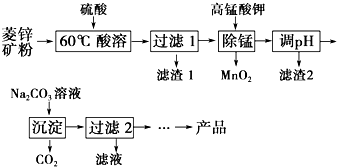 以菱锌矿(主要成分为ZnCO3,同时含有MnO、FeO、Fe2O3、SiO2等杂质)为原料生产碱式碳酸锌[ZnCO3•2Zn(OH)2•H2O]的工艺流程如图.已知Fe2+、Fe3+、Zn2+生成氢氧化物沉淀的pH见表:
以菱锌矿(主要成分为ZnCO3,同时含有MnO、FeO、Fe2O3、SiO2等杂质)为原料生产碱式碳酸锌[ZnCO3•2Zn(OH)2•H2O]的工艺流程如图.已知Fe2+、Fe3+、Zn2+生成氢氧化物沉淀的pH见表:| 待沉淀离子 | Fe2+ | Fe3+ | Zn2+ |
| 开始沉淀时pH | 5.8 | 1.1 | 5.9 |
| 完全沉淀时pH | 8.8 | 3.2 | 8.0 |
(2)用KMnO4溶液除去Mn2+的离子方程式为2MnO4-+3Mn2++2H2O═5MnO2↓+4H+.
(3)滤渣2主要成分的化学式是Fe(OH)3.
(4)过滤2所得滤液中含有的主要阳离子是Na+、K+.
(5)生成的产品需经充分洗涤,检验产品完全洗净的方法是取最后一次洗涤液,加盐酸酸化的氯化钡溶液,若无沉淀,则已洗净.
(6)Zn2+完全沉淀时溶液中c(Zn2+)=10-5mol•L-1,则该温度下Ksp[Zn(OH)2]的值为10-17.
 如图,在光照条件下,将盛有CH4和Cl2的量筒倒扣于盛有饱和食盐水的水槽中进行实验,对实验现象及产物分析中错误的是 ( )
如图,在光照条件下,将盛有CH4和Cl2的量筒倒扣于盛有饱和食盐水的水槽中进行实验,对实验现象及产物分析中错误的是 ( )| A. | 混合气体的颜色变浅,量筒中液面上升 | |
| B. | 量筒内壁上出现的油状液滴,应只是三氯甲烷、四氯甲烷的混合物 | |
| C. | 已知HCl可降低NaCl的溶解度,故水槽中有固体物质析出 | |
| D. | 甲烷与氯气反应后的产物只有CCl4 |
| A. | 原子半径:X>Y>Z | B. | 气态氢化物的稳定性HX>H2Y>ZH3 | ||
| C. | 电负性:X>Y>Z | D. | 非金属性:X>Y>Z |
| A. | 分子间作用力与化学键的键能大小相当 | |
| B. | 分子间作用力远强于化学键,是一种很强的作用 | |
| C. | 氢键主要影响物质的化学性质 | |
| D. | 分子内部的相邻原子之间强烈的相互作用称为化学键,而分子之间存在的相互作用称为分子间作用力 |
 表示的分子式C6H14结构简式CH3CH(CH3)CH2CH2CH3名称是2-甲基戊烷.
表示的分子式C6H14结构简式CH3CH(CH3)CH2CH2CH3名称是2-甲基戊烷.
