题目内容
7.A~J均为有机化合物,它们之间的转化如下图所示:
已知:
(1)D既能发生银镜反应,又能与金属钠反应放出氢气
(2)F是环状化合物,核磁共振氢谱表明F分子中有三种氢,且其峰面积之比为1:1:1.
(3)G是环状化合物,能使溴的四氯化碳溶液褪色.
(4)1mol J与足量金属钠反应可放出22.4L氢气(标准状况).
请根据以上信息回答下列问题:
①A的结构简式为BrCH2CH=CHCH2Br由A生成B的反应类型是取代或水解反应
②C转化为D的方程式为2CH2OHCH2CH2CH2OH+O2$→_{△}^{Cu}$2CH2OHCH2CH2CHO+2H2O
③由E生成F的化学方程式为
 ,H中的非含氧官能团有氯原子(填名称),与E具有相同官能团的E的同分异构体还有
,H中的非含氧官能团有氯原子(填名称),与E具有相同官能团的E的同分异构体还有 (任写一个,不考虑立体结构);
(任写一个,不考虑立体结构);④G的结构简式为
 .
.
分析 D分子的不饱和度=$\frac{4×2+2-8}{2}$=1,说明该分子中含有1个双键,D既能发生银镜反应,又能与金属钠反应放出氢气,则D中含有醛基和醇羟基,D发生银镜反应然后酸化得到的E中含有羧基和醇羟基,E反应生成F,F是环状化合物,核磁共振氢谱表明F分子中有三种氢,且其峰面积之比为1:1:1,E发生酯化反应生成F,结合F分子式知,F结构简式为 ,则E为HOCH2CH2CH2COOH、D为HOCH2CH2CH2CHO、C为HOCH2CH2CH2CH2OH、B为HOCH2CH=CHCH2OH,A为BrCH2CH=CHCH2Br,生成A的反应为1,4-加成反应;
,则E为HOCH2CH2CH2COOH、D为HOCH2CH2CH2CHO、C为HOCH2CH2CH2CH2OH、B为HOCH2CH=CHCH2OH,A为BrCH2CH=CHCH2Br,生成A的反应为1,4-加成反应;
G是环状化合物,能使溴的四氯化碳溶液褪色,说明G中含有碳碳双键,结合G分子式知,B发生取代反应生成G,G结构简式为 ,
,
G→H应该是G与HClO发生加成反应,H应该为 ;H→I是:2
;H→I是:2 +Ca(OH)2=2
+Ca(OH)2=2 +CaCl2+2 H2O;I→J是醚的开环,五元环相对于三元环稳定,因此反应为:
+CaCl2+2 H2O;I→J是醚的开环,五元环相对于三元环稳定,因此反应为: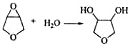 ,据此分析解答.
,据此分析解答.
解答 解:D分子的不饱和度=$\frac{4×2+2-8}{2}$=1,说明该分子中含有1个双键,D既能发生银镜反应,又能与金属钠反应放出氢气,则D中含有醛基和醇羟基,D发生银镜反应然后酸化得到的E中含有羧基和醇羟基,E反应生成F,F是环状化合物,核磁共振氢谱表明F分子中有三种氢,且其峰面积之比为1:1:1,E发生酯化反应生成F,结合F分子式知,F结构简式为 ,则E为HOCH2CH2CH2COOH、D为HOCH2CH2CH2CHO、C为HOCH2CH2CH2CH2OH、B为HOCH2CH=CHCH2OH,A为BrCH2CH=CHCH2Br,生成A的反应为1,4-加成反应;
,则E为HOCH2CH2CH2COOH、D为HOCH2CH2CH2CHO、C为HOCH2CH2CH2CH2OH、B为HOCH2CH=CHCH2OH,A为BrCH2CH=CHCH2Br,生成A的反应为1,4-加成反应;
G是环状化合物,能使溴的四氯化碳溶液褪色,说明G中含有碳碳双键,结合G分子式知,B发生取代反应生成G,G结构简式为 ,
,
G→H应该是G与HClO发生加成反应,H应该为 ;H→I是:2
;H→I是:2 +Ca(OH)2=2
+Ca(OH)2=2 +CaCl2+2 H2O;I→J是醚的开环,五元环相对于三元环稳定,因此反应为:
+CaCl2+2 H2O;I→J是醚的开环,五元环相对于三元环稳定,因此反应为: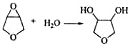 ,
,
①通过以上分析知,A结构简式为BrCH2CH=CHCH2Br,A发生取代反应或水解反应生成B,
故答案为:BrCH2CH=CHCH2Br; 取代(或水解);
②该反应方程式为2CH2OHCH2CH2CH2OH+O2$→_{△}^{Cu}$2CH2OHCH2CH2CHO+2H2O,故答案为:2CH2OHCH2CH2CH2OH+O2$→_{△}^{Cu}$2CH2OHCH2CH2CHO+2H2O;
③E发生酯化反应生成F,反应方程式为 ,H为
,H为 ,H中非含氧官能团为氯原子;E为HOCH2CH2CH2COOH,与E具有相同官能团的E的同分异构体还有
,H中非含氧官能团为氯原子;E为HOCH2CH2CH2COOH,与E具有相同官能团的E的同分异构体还有 ,
,
故答案为: ;氯原子;
;氯原子; ;
;
④G结构简式为 ,故答案为:
,故答案为: .
.
点评 本题考查有机物推断,为高频考点,侧重考查学生分析推断及信息的综合运用能力,正确推断F结构简式是解本题关键,然后采用正逆结合的方法进行推断,难点是同分异构体种类判断,题目难度中等.

 口算题天天练系列答案
口算题天天练系列答案| A. | 氨水跟盐酸反应:OH-+H+→H2O | |
| B. | 铁与硝酸银溶液反应:Fe+Ag+→Fe2++Ag | |
| C. | 氢氧化铜与稀硫酸反应:Cu(OH)2+2H+→Cu2++2H2O | |
| D. | 氢氧化钡跟稀硫酸反应:Ba2++OH-+H++SO42-→BaSO4↓+H2O |
| A. | H2SO4和Ba(OH)2 | B. | CO2和NaOH | C. | CaCO3和HCl | D. | Mg(OH)2和CuSO4 |
| A. | 将溶液稀释到原体积的2倍 | B. | 加入适量的醋酸钠固体 | ||
| C. | 加入等体积0.2 mol•L-1盐酸 | D. | 加少量冰醋酸 |
| A. | 碳酸钠固体 | B. | 少量锌粉 | C. | 硫酸钾溶液 | D. | 盐酸溶液 |
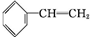 +Br2→
+Br2→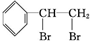 ;
; ;
; .
. .
.