题目内容
8. 煤是重要的能源,也是生产化工产品的重要原料.试用所学知识,解答下列问题:
煤是重要的能源,也是生产化工产品的重要原料.试用所学知识,解答下列问题:(1)煤的转化技术包括煤的气化技术和液化技术.煤的液化技术又分为直接液化技术和间接液化技术.
(2)在煤燃烧前需对煤进行脱硫处理.煤的某种脱硫技术的原理如图所示:
FeS2$→_{O_{2}/H_{2}O}^{在微生物作用下}$Fe2++SO${\;}_{4}^{2-}$$→_{O_{2}/H+}^{微生物作用下}$Fe 3+
这种脱硫技术称为微生物脱硫技术.该技术的第一步反应的离子方程式为2FeS2+7O2+2H2O=4H++2Fe2++4SO42-;第二步反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O.
(3)工业煤干馏得到的产品有焦炭、焦炉煤气、粗氨水、煤焦油等.
(4)湿式石灰石-石膏法脱硫工艺是烟气脱硫技术中最成熟的一种方法.其工艺流程是:烟气经锅炉预热器出来,进入电除尘器除掉大部分粉煤灰烟尘,再经过一个专门的热交换器,然后进入吸收塔,烟气中的SO2与含有石灰石的浆液进行气液接触,通入空气后生成石膏,经脱硫的烟气,应用循环气体加热器进行再加热,进入烟囱,排入大气.
①写出湿法石灰石-石膏法脱硫所涉及的化学反应方程式:SO2+CaCO3=CaSO3+CO2,2CaSO3+O2+4H2O=2(CaSO4•2H2O).
②用石灰石浆液作SO2吸收剂而不用熟石灰吸收SO2的原因是:用石灰石浆液的成本较低.
③上述过程中得到的石膏,如果含氯化合物(主要来源于燃料煤)超过杂质极限值,则石膏产品性能变坏.工业上消除可溶性氯化物的方法是用水洗涤.
(5)某化学兴趣小组为了测定烟气脱硫所得石膏的组成(CaSO4•xH2O)即测定x值,做如下实验:将石膏加热使之脱水,加热过程中固体的质量与时间的变化关系如图所示.数据表明当固体的质量为2.72g后不再改变.①石膏的化学式为CaSO4•2H2O.②图象中AB段对应化合物的化学式为2CaSO4•H2O.
分析 (1)根据不同的加工路线,煤炭液化可分为直接液化和间接液化两大类;
(2)根据化合价升降总数相等以及原子守恒来写离子方程式;
(3)工业煤干馏得到的产品有焦炭、焦炉煤气、粗氨水、煤焦油;
(4)①二氧化硫与碳酸钙反应生成亚硫酸钙与二氧化碳,亚硫酸钙在水存在的条件下被氧气氧化生成CaSO4•2H2O; ②石灰石浆液的价格低;
③硫酸钙微溶于水;
(5)根据题意可知加热前和加热后质量的减少量就是生成水的质量,由实验数据知3.44g CaSO4•xH2O完全分解得到无水CaSO42.72g,可知生成水的质量为:3.44g-2.72g=0.72g,由水的质量和硫酸钙的质量可推算出生石膏的化学式,再根据A-B段时石膏的质量为2.90g,其中CaSO42.72g,H2O0.18g,所以图象中产生AB段的原因是石膏的质量为2.90g,其中CaSO42.72g,H2O 为0.18g.此时其化学式可表示为2CaSO4•H2O.该物质化学性质稳定,受热不易分解.
解答 解:(1)煤直接液化煤在氢气和催化剂作用下,通过加氢裂化转变为液体燃料的过程称为直接液化;煤间接液化间接液化是以煤为原料,先气化制成合成气,然后,通过催化剂作用将合成气转化成烃类燃料、醇类燃料和化学品的过程,故答案为:直接液化技术;间接液化技术;
(2)第一步反应中反应物有FeS2、O2和H2O,生成物有Fe2+和SO42-,根据化合价升降总数相等以及原子守恒,反应的离子方程式为:2FeS2+7O2+2H2O=4H++2Fe2++4SO42-;Fe2+具有还原性,可被氧气氧化为Fe3+,根据化合价升降总数相等以及原子守恒,反应的离子方程式为:4Fe2++O2+4H+=4Fe3++2H2O,
故答案为:2FeS2+7O2+2H2O=4H++2Fe2++4SO42-;4Fe2++O2+4H+=4Fe3++2H2O;
(3)工业煤干馏得到的产品有焦炭、焦炉煤气、粗氨水、煤焦油;故答案为:焦炉煤气、粗氨水、煤焦油;
(4)①二氧化硫与碳酸钙反应生成亚硫酸钙与二氧化碳,反应方程式为:SO2+CaCO3=CaSO3+CO2,亚硫酸钙在水存在的条件下被氧气氧化生成CaSO4•2H2O,反应方程式为:2CaSO3+O2+4H2O=2(CaSO4•2H2O),故答案为:SO2+CaCO3=CaSO3+CO2,2CaSO3+O2+4H2O=2(CaSO4•2H2O);
②石灰石浆液的价格低,故答案为:用石灰石浆液的成本较低;
③硫酸钙微溶于水,氯化物易溶于水,故答案为:用水洗涤;
(5)①石膏加热分解减少的质量就是水的质量,已知3.44g CaSO4•xH2O完全分解得到无水CaSO42.72g,则:
CaSO4•xH2O═CaSO4+xH2O
136 18x
2.72 0.72
即$\frac{136}{2.72}$=$\frac{18x}{0.72}$
解得x=2 所以石膏的化学式为CaSO4•2H2O;故答案为:CaSO4•2H2O;
②由实验数据知在A-B段时石膏的质量为2.90g,其中CaSO42.72g,H2O为2.90g-2.72g=0.18g.CaSO4的物质的量为$\frac{2.72g}{136g/mol}$=0.02mol,H2O的物质的量为$\frac{0.18g}{18g/mol}$=0.01mol,此时其化学式可表示为2CaSO4•H2O,故答案为:2CaSO4•H2O.
点评 本题考查煤的综合利用,涉及到氧化还原方程式的书写和结晶水合物的判断,题目难度中等,解题的关键是反应前后质量的减少量就是生成水的质量.

| A. | 32g/mol | B. | 64 | C. | 64g/mol | D. | 4g |
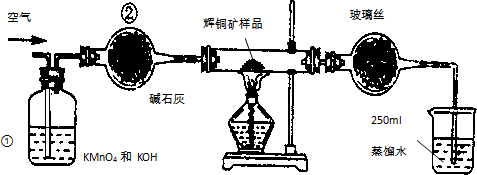
 工业上为了测定辉铜矿(主要成分是Cu2S)中Cu2S的质量分数,设计了如图装置.实验时按如下步骤操作:
工业上为了测定辉铜矿(主要成分是Cu2S)中Cu2S的质量分数,设计了如图装置.实验时按如下步骤操作:A.连接全部仪器,使其成为如图装置,并检查装置的气密性.
B.称取研细的辉铜矿样品1.000g.
C.将称量好的样品小心地放入硬质玻璃管中.
D.以每分钟1L的速率鼓入空气.
E.将硬质玻璃管中的辉铜矿样品加热到一定温度,发生反应为:Cu2S+O2═SO2+2Cu.
F.移取25.00ml含SO2的水溶液于250ml锥形瓶中,用0.0100mol/L KMnO4标准溶液滴定至终点.按上述操作方法重复滴定2-3次.
试回答下列问题:
(1)装置①的作用是除去空气中可能含有的SO2等气体;装置②的作用是干燥气体.
(2)假定辉铜矿中的硫全部转化为SO2,并且全部被水吸收,则操作F中所发生反应的化学方程式为2KMnO4+5H2SO3=2MnSO4+K2SO4+2H2SO4+3H2O;
(3)若操作F的滴定结果如表所示,则辉铜矿样品中Cu2S的质量分数是80%.
| 滴定 次数 | 待测溶液的 体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.04 | 21.03 |
| 2 | 25.00 | 1.98 | 21.99 |
| 3 | 25.00 | 3.20 | 21.24 |
(5)已知在常温下FeS 的Ksp=6.25×10-18,H2S 饱和溶液中c(H+)与c(S${\;}_{2}^{-}$)之间存在如下关系:c2(H+)•c(S2-)=1.0×10-22.在该温度下,将适量 FeS 投入硫化氢饱和溶液中,欲使溶液中(Fe2+)为 lmol/L,应调节溶液的c(H+)为4×10-3mol/L.
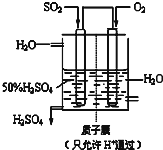
(6)某人设想以如图所示装置用电化学原理生产硫酸,写出通入SO2的电极的电极反应式SO2-2e-+2H2O=SO42-+4H+.
| A. | 与铝反应放出氢气的溶液中:Na+、Cl-、S2-、SO32- | |
| B. | 常温下$\frac{{k}_{w}}{c({H}^{+})}$=1×10-13mol•L-1的溶液中:Ca2+、Fe2+、NO3-、NH4+ | |
| C. | 水电离出的c(H+)=10-10mol•L-1的溶液中Na+、K+、Cl-、HCO3- | |
| D. | 0.5mol•L-1AlCl3溶液中可能大量存在[Al(OH)4]-、K+、CO32- |
 用铅蓄电池电解苦卤水(含C1-、Br-、Na+、Mg2+)的装置如图所示(a、b为石墨电极).下列说法中正确的是( )
用铅蓄电池电解苦卤水(含C1-、Br-、Na+、Mg2+)的装置如图所示(a、b为石墨电极).下列说法中正确的是( )| A. | 铅蓄电池放电时,该电池两极质量均减小 | |
| B. | 铅蓄电池充电时,B极应与外电源负极相连 | |
| C. | 电解苦卤水时,a电极首先放电的是Cl-而不是Br-,因为Cl-的还原性强于Br- | |
| D. | 当b极产生0.01 mol 气体时,铅蓄电池中消耗0.02 molH2SO4 |

已知:SO2熔点-72℃,沸点-10℃;SO3熔点16.8℃,沸点44.8℃.
| 实验过程 | 实验现象 | |
| ① | 通入一段时间N2,加热 | A中固体变为红棕色,B中有白色沉淀,D试管中有无色液体 |
| ② | 用带有火星的木条靠近装置D的导管口 | 木条复燃 |
| ③ | 充分反应,停止加热,冷却后,取A中固体,加盐酸 | 固体溶解,溶液呈黄色 |
| ④ | 将③所得溶液滴入D试管中 | 溶液变为浅绿色 |
(2)实验③反应的离子方程式是Fe2O3+6H+=2Fe3++3H2O.
(3)分解过程除产生使木条复燃的气体外,仅由A中固体颜色变化推测,还一定有SO2气体.依据是因为有Fe2O3生成,在FeSO4中只有+6价S元素有氧化性,能被还原.因此一定有SO2生成.
(4)实验④反应的离子方程式是2Fe3++SO2+2H2O=2Fe2++SO42-+4H+.
