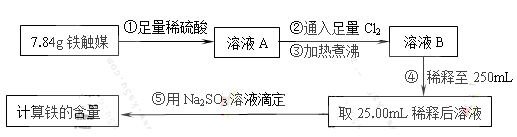
题目内容
以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下: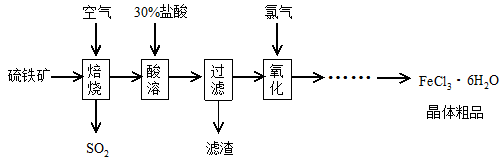
回答下列问题:
(1)焙烧硫铁矿的主要方程式为 。
(2)酸溶及后续过程中均需保持盐酸过量,其目的是提高铁元素的浸出率、 。
(3)通氯气氧化后时,发生的主要反应的离子方程式为 ;该过程产生的尾气可用碱溶液吸收,尾气中污染空气的气体为(写化学式) 。
(4)在氧化过程中,如何检验铁元素全部以Fe3+形式存在: 。
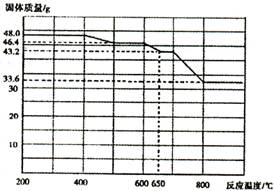
(5)如果将氯化铁晶体(FeCl3·6H2O)放在坩埚中加热灼烧,最后得到的固体为 。
(6)在一定条件下,SO2转化为SO3的反应为2SO2(g)+O2(g) 2SO3(g),该反应的平衡常数表达式为K= ; 工业在接触法制硫酸的生产中,采取下列哪些措施有利于提高SO2转化率 。
2SO3(g),该反应的平衡常数表达式为K= ; 工业在接触法制硫酸的生产中,采取下列哪些措施有利于提高SO2转化率 。
①V2O5作崔化剂 ②通入过量O2 ③SO2、O2进行二次氧化 ④通入过量SO2
(1)4 FeS2 + 11 O2 2 Fe2O3 + 8SO2(2分)
2 Fe2O3 + 8SO2(2分)
(2)抑制Fe3+水解(2分)
(3)Cl2+Fe2+=2Cl-+Fe3+ (2分) Cl2 HCl(2分)
(4)取氧化后的溶液少许于试管中,往试管中滴加1~2滴酸性KMnO4溶液,KMnO4的紫红色不褪去,说明铁元素全部以Fe3+形式存在。(2分)
(5)Fe2O3(2分)
(6)k=c2(SO3)/c(O2)·c2(SO2) (2分) ②③(2分)
解析试题分析:(1)焙烧硫铁矿是硫酸工业中制取二氧化硫气体的重要步骤,发生的氧化还原反应配平比较困难,利用电子得失守恒配平得: 4 FeS2 + 11 O2 2 Fe2O3 + 8SO2(2分)
2 Fe2O3 + 8SO2(2分)
(2)酸溶焙烧产物不仅是提高浸出率,还可以抑制溶解得到的Fe3+水解。
(3)因为最终要得到的产品是氯化铁晶体,所以可能焙烧不完全,仍有部分亚铁离子,所以加入氧化剂氯气氧化除去,发生的反应为Cl2+Fe2+=2Cl-+Fe3+ ,该过程可能有氯气溶于水产生挥发性的HCl以及过量的Cl2,所以可以用碱吸收。
(4)检验是否全部转化为Fe3+ ,就是检验Fe2+ 的存在,所以检验Fe2+ 可以使用高锰酸钾试剂,所以操作为:取氧化后的溶液少许于试管中,往试管中滴加1~2滴酸性KMnO4溶液,KMnO4的紫红色不褪去,说明铁元素全部以Fe3+形式存在。
(5)氯化铁晶体(FeCl3·6H2O)含有水分,所以加热灼烧过程中,FeCl3 会发生水解并最终得到稳定的氧化物Fe2O3 。
(6)根据方程式可以写出平衡常数表达式为k=c2(SO3)/c(O2)·c2(SO2);要提高SO2 的转化率,则需要使平衡正向移动或SO2 二次利用,所以可行的是②、③。
考点:本题考查的是工业制硫酸和化学反应原理知识。

某兴趣小组用废铁泥(主要成分为Fe2O3、FeO和少量Fe)制备磁性Fe3O4纳米材料的流程示意图如下: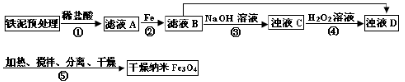
|
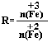 ,步骤⑤中,相同条件下测得Fe3O4的产率与R的关系如图所示。
,步骤⑤中,相同条件下测得Fe3O4的产率与R的关系如图所示。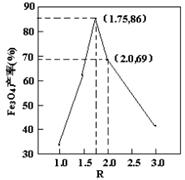
(1)步骤②中,主要反应的离子方程式是______。
(2)已知:Fe3+在pH=2.8时沉淀完全; Fe2+在pH=6.3时开始沉淀,在pH=8.3时沉淀完全。
步骤③中,用NaOH溶液调pH至9,原因是______。
(3)浊液D中铁元素以FeOOH形式存在。步骤④中,反应的化学方程式是______。
(4)下列说法正确的是______(选填字母)。
a.步骤④中,当反应完成后需再加热一段时间
b.步骤⑤中,反应过程中需要不断补充碱液
c.步骤⑤恰好反应时,n(FeOOH)/n(Fe2+)="2:1"
d.当n(浊液D中FeOOH)/n(滤液B中的铁元素)=4/7时,Fe3O4的产率最高


 6Cu+SO2
6Cu+SO2 2CuO,CuO+H2SO4=CuSO4+H2O
2CuO,CuO+H2SO4=CuSO4+H2O
 ,该反应的还原剂是__________。当有1mol MoS2反应时,还原剂失去电子的物质的量为________。
,该反应的还原剂是__________。当有1mol MoS2反应时,还原剂失去电子的物质的量为________。