题目内容
根据相关化学知识分析,下列推断正确的是( )
分析:A、根据质量数=质子数+中子数;
B、根据盐水解规律:越弱越水解来回答;
C、根据加水时电离平衡正向移动,n(NH4+)增大,n(NH3?H2O)减小,在同一溶液中体积相同,离子的浓度之比等于物质的量之比;
D、氧化还原反应中,氧化剂的氧化性强于氧化产物的氧化性.
B、根据盐水解规律:越弱越水解来回答;
C、根据加水时电离平衡正向移动,n(NH4+)增大,n(NH3?H2O)减小,在同一溶液中体积相同,离子的浓度之比等于物质的量之比;
D、氧化还原反应中,氧化剂的氧化性强于氧化产物的氧化性.
解答:解:A、若X原子中的质子数为a,中子数为b,则X的质量数为a+b,故A错误;
B、酸越弱,形成的钠盐碱性越强,所以弱酸HA的酸性强于弱酸HB,则相同条件下同浓度钠盐溶液的pH:NaB>NaA,故B正确;
C、加水时电离平衡正向移动,n(NH4+)增大,n(NH3?H2O)减小,在同一溶液中体积相同,离子的浓度之比等于物质的量之比,则则
增大,故C正确;
D、氧化还原反应中,氧化剂的氧化性强于氧化产物的氧化性,由方程式A2+2D-=2A-+D2可知,A2的氧化性强于D2,故D错误;
故选BC.
B、酸越弱,形成的钠盐碱性越强,所以弱酸HA的酸性强于弱酸HB,则相同条件下同浓度钠盐溶液的pH:NaB>NaA,故B正确;
C、加水时电离平衡正向移动,n(NH4+)增大,n(NH3?H2O)减小,在同一溶液中体积相同,离子的浓度之比等于物质的量之比,则则
| c(NH4+) |
| c(NH3?H2O) |
D、氧化还原反应中,氧化剂的氧化性强于氧化产物的氧化性,由方程式A2+2D-=2A-+D2可知,A2的氧化性强于D2,故D错误;
故选BC.
点评:本题是一道综合知识题目,考查学生分析和解决问题的能力,易错点为C,明确离子的物质的量的变化与浓度的变化的区别是解答的关键,并注意稀释时溶液的体积增大来分析解答.

练习册系列答案
相关题目

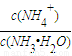 增大
增大