题目内容
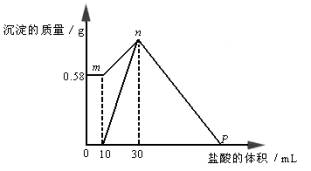
把由NaOH、AlCl3、MgCl2三种固体组成的混合物溶于足量的水中,有0.58g白色沉淀析出,向所得浊液里逐滴加入0.5mol×L-1的盐酸,加入盐酸的体积和生成沉淀的质量如图所示。试判断P点表示的盐酸的体积是( )A.100Ml B.110mL
C.120mL D.130mL
答案:D
解析:
解析:
| 精析 从图中看出,加入10mLHCl溶液时沉淀量没有变化,这说明加入的盐酸被NaOH溶液中和了,据此可确定0.58g沉淀仅仅是Mg(OH)2。因溶液呈碱性,故没有A1(OH)3沉淀,溶液中有NaAlO2。再加入20mLHCl溶液时得到的沉淀应为Mg(OH)2和A1(OH)3沉淀。由此可以算出:n[Mg(OH)
|

练习册系列答案
 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案
相关题目
 把由NaOH、AlCl3与MgCl2三种固体组成的混合物溶于足量水中,有2.9g白色沉淀析出,向所得的浊液里逐滴加入2mol?L-1的盐酸,加入盐酸的体积和生成沉淀的质量关系如图所示.试判断p点所表示的加入盐酸的体积是( )
把由NaOH、AlCl3与MgCl2三种固体组成的混合物溶于足量水中,有2.9g白色沉淀析出,向所得的浊液里逐滴加入2mol?L-1的盐酸,加入盐酸的体积和生成沉淀的质量关系如图所示.试判断p点所表示的加入盐酸的体积是( )| A、135 mL | B、145 mL | C、155 mL | D、165 mL |
 Ⅰ把由NaOH、AlCl3、MgCl2三种固体组成的混合物,溶于足量水中,有0.58g白色沉淀析出,向所得浊液中,逐滴加入1mol/L盐酸,加入盐酸的体积和生成沉淀的质量如图所示.
Ⅰ把由NaOH、AlCl3、MgCl2三种固体组成的混合物,溶于足量水中,有0.58g白色沉淀析出,向所得浊液中,逐滴加入1mol/L盐酸,加入盐酸的体积和生成沉淀的质量如图所示.

